Благородные металлы, такие как платина, золото и серебро, отличаются особым химическим поведением при взаимодействии с кислотами. Их высокая устойчивость и инертность проявляются в способности не подвергаться окислению и растворению даже в агрессивных средах. Это делает благородные металлы их соединения и сплавы незаменимыми во многих областях науки и техники.
Одной из основных особенностей взаимодействия благородных металлов с кислотами является их способность поверхностной пассивации. Реакция между металлом и кислотой приводит к образованию пленки оксида на поверхности металла, которая защищает его от дальнейшего взаимодействия с кислотой. Таким образом, благородные металлы характеризуются высокой устойчивостью к химическому разрушению в контакте с кислотами.
Применение благородных металлов в кислотных средах находит широкое применение в различных отраслях. Например, платина используется в катализаторах в процессе производства удобрений и неорганического азота, серебро применяется в фармацевтической промышленности и электронике, а золото используется для изготовления электродов в электрохимических процессах.
Также стоит отметить, что благородные металлы могут проявлять особую активность в некоторых кислотах. Например, некоторые соединения платины обладают каталитической активностью в серной кислоте, а золото может проявлять активность в азотной кислоте. Это позволяет использовать эти металлы в различных процессах, связанных с преобразованием веществ, например, в процессах окисления и разложения органических соединений.
Таким образом, взаимодействие благородных металлов с кислотами имеет свои особенности, которые определяют их устойчивость и активность в различных средах. Использование этих металлов и их соединений в кислотах находит широкое применение в различных отраслях науки и техники, что делает их незаменимыми материалами для реализации различных процессов и производств.
Особенности и применение взаимодействия благородных металлов с кислотами
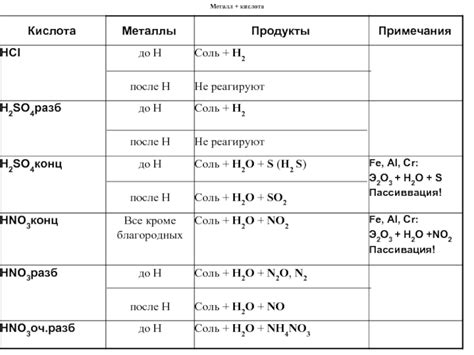
Благородные металлы, такие как золото, платина и серебро, проявляют уникальные свойства при взаимодействии с кислотами. Они обладают высокой устойчивостью к окислению и коррозии, что делает их непревзойденными материалами для различных приложений.
Взаимодействие благородных металлов с кислотами основано на их электрохимических свойствах. При контакте с кислотами происходит электрохимическая реакция, в результате которой металлы проявляют свою устойчивость и не подвергаются разрушению. Они покрываются плотной и прочной пленкой оксида, которая создает защитный барьер от дальнейшего взаимодействия с кислотой.
Благородные металлы с успехом применяются в различных отраслях индустрии благодаря своим уникальным свойствам. Например, золото используется в электронике для создания контактных площадок и проводников благодаря своей низкой электрической сопротивляемости и устойчивости к окислению. Платина широко применяется в катализаторах для ускорения химических реакций, а серебро используется в фотографии, медицине и производстве посуды.
Особенности взаимодействия благородных металлов с кислотами сделали их незаменимыми материалами во многих сферах деятельности. Их высокая устойчивость и стабильность обеспечивают долговечность и надежность изделий, что делает их ценными ресурсами для различных индустрий.
Реакции благородных металлов с кислородными кислотами
Благородные металлы, такие как платина, золото и серебро, проявляют особые свойства при взаимодействии с кислородными кислотами. Кислородные кислоты, такие как серная кислота, азотная кислота и хлорноватистая кислота, являются сильными окислителями и способны реагировать с благородными металлами.
При взаимодействии с платиной, кислородные кислоты способны окислять этот металл, образуя соответствующие соли, например, хлорплатиновую кислоту. Такие реакции имеют широкое применение в индустрии для получения платиновых соединений, используемых в качестве катализаторов и в производстве фармацевтических препаратов.
Золото также вступает в реакцию с кислородными кислотами, образуя соответствующие соли. Кислотное растворение золота используется при получении золотых солей, которые находят применение в электротехнике, позолоте и производстве ювелирных изделий.
Реакция серебра с кислородными кислотами приводит к образованию соответствующих солей серебра, например, нитрат серебра. Серебряные соли широко используются в фотографии, а также в медицине и косметологии благодаря своим антисептическим и противомикробным свойствам.
Таким образом, реакции благородных металлов с кислородными кислотами имеют большое практическое значение и используются в различных отраслях промышленности. Они позволяют получать ценные соединения благородных металлов, которые находят применение в производстве катализаторов, электротехнике, фотографии и других областях.
Влияние хлороводородных и сероводородных кислот на благородные металлы

Хлороводородная и сероводородная кислоты оказывают значительное влияние на благородные металлы, такие как золото, платина и серебро.
Хлороводородная кислота, также известная как соляная кислота, обладает сильными окислительными свойствами и может вызывать коррозию благородных металлов. Взаимодействие хлороводородной кислоты с металлами приводит к выделению диоксида хлора, который может нанести серьезный вред металлической поверхности.
Сероводородная кислота, известная также как серная кислота, также может вызывать коррозию благородных металлов. Она особенно сильно воздействует на золото и платину, приводя к их поверхностной коррозии и потере блеска. Сероводородная кислота образует соединения с благородными металлами, которые могут иметь токсические свойства и негативно влиять на их применение.
Из-за влияния хлороводородных и сероводородных кислот на благородные металлы, при их использовании необходимо принимать соответствующие меры предосторожности и использовать защитные покрытия или обработку поверхности металла, чтобы предотвратить коррозию и сохранить его эстетический вид.
Окислительные свойства благородных металлов
Благородные металлы, такие как золото, платина и серебро, обладают высокой устойчивостью к окислению и сохраняют свою благородность даже в присутствии кислот. Однако, несмотря на это, они все же проявляют легкую способность к окислению в некоторых условиях.
Окислительные свойства благородных металлов проявляются при взаимодействии с кислородом или другими окислителями. Например, аммиак (NH3) может служить окислителем для благородных металлов: он образует соединения с золотом, платиной и серебром, которые имеют различные цвета и свойства.
Также благородные металлы могут проявлять окислительные свойства при взаимодействии с кислотами. Они способны окислять некоторые вещества, например, водород или соединения с низкой степенью окисления. При этом благородные металлы сами становятся восстановленными.
Эти особенности окислительных свойств благородных металлов находят применение в различных областях, например, в катализе и электрохимии. Благородные металлы широко используются в качестве катализаторов для различных реакций, таких как окисление, водородация и гидрирование. Кроме того, благородные металлы используются в электрохимических процессах, например, в производстве аккумуляторов или водородных топливных элементов.
Применение благородных металлов в каталитических процессах

Благородные металлы, такие как платина, палладий и родий, имеют широкое применение в каталитических процессах. Каталитические процессы являются важным инструментом в химической промышленности и позволяют значительно увеличить скорость химических реакций.
Одной из основных областей применения благородных металлов в катализе является автомобильная промышленность. Платина, палладий и родий используются в катализаторах для очистки отработанных газов, особенно от оксидов азота и углеводородов. Эти металлы способны эффективно преобразовывать вредные вещества в более безопасные соединения.
Кроме того, благородные металлы находят широкое применение в производстве лекарств. Они используются в катализаторах для синтеза сложных органических соединений, в том числе и медицинских препаратов. Благодаря своей активности и селективности, платина, палладий и родий позволяют получать высокоочищенные продукты без образования побочных продуктов.
Не менее важным направлением применения благородных металлов в катализе является производство химических веществ. Они используются в катализаторах для различных процессов, таких как гидрогенирование, окисление и дегидрирование. Благодаря своим уникальным свойствам, благородные металлы обеспечивают высокую эффективность и стабильность каталитических процессов.
Итак, благородные металлы имеют широкое применение в каталитических процессах, играя важную роль в химической промышленности. Они позволяют ускорить химические реакции, очищать газы от вредных веществ и производить сложные органические соединения. Применение благородных металлов в катализе способствует снижению вредного воздействия на окружающую среду и обеспечивает производство высококачественных продуктов.
Коррозионная стойкость благородных металлов в кислой среде
Благородные металлы, такие как золото, платина и серебро, обладают высокой коррозионной стойкостью в кислых средах. Это свойство делает их незаменимыми материалами для различных технических и научных областей, где важно сохранить целостность материала при взаимодействии с кислотами.
Кроме того, благородные металлы часто используются в производстве электродов и каталитических систем, где необходимо поддерживать стабильные химические свойства в кислой среде. Например, платиновые электроды применяются в электрохимических процессах, таких как электролиз, а также в производстве топливных элементов и аккумуляторов.
У благородных металлов также есть особенность – они образуют защитную пленку на своей поверхности, которая защищает металл от дальнейшей коррозии в кислых средах. Эта пленка состоит из оксидов или других соединений металла, обладающих стабильными химическими свойствами.
Таким образом, благородные металлы демонстрируют высокую коррозионную стойкость в кислых средах, что делает их важными материалами для различных промышленных и научных приложений, а также позволяет использовать их в электрохимических процессах и каталитических системах. Наличие защитной пленки на поверхности металла обеспечивает долговечность и стабильность химических свойств благородных металлов в таких условиях.
Биомедицинское применение благородных металлов

Благородные металлы, такие как платина, золото и серебро, нашли широкое применение в биомедицине благодаря своим уникальным свойствам.
Платина является основным компонентом многих лекарственных препаратов, используемых в онкологии. Благодаря своей высокой химической инертности, платина способна эффективно взаимодействовать с ДНК клеток рака, блокируя их деление и приводя к их гибели.
Золото имеет прекрасные биологические свойства и широко используется в различных медицинских технологиях. В частности, золотые наночастицы могут использоваться для доставки препаратов в организм, улучшения диагностики рака и лечения воспалительных заболеваний.
Серебро обладает сильным антимикробным действием и часто используется для создания антимикробных поверхностей и изделий. Серебряные ионы могут уничтожать бактерии, вирусы и грибки, что делает серебро ценным материалом для применения в медицине и гигиене.
Биомедицинское применение благородных металлов продолжает активно развиваться, и их уникальные свойства позволяют вносить существенный вклад в современную медицину.
Вопрос-ответ
Какие благородные металлы существуют?
Существует несколько благородных металлов, таких как золото, платина, палладий, родий, и их комбинации.
Почему благородные металлы считаются "благородными"?
Благородные металлы называют такими из-за их химической инертности, то есть они не подвержены коррозии и реакциям с другими веществами при обычных условиях.
Как благородные металлы взаимодействуют с кислотами?
Благородные металлы обычно не реагируют с кислотами. Однако, некоторые сильные окисляющие кислоты, такие как концентрированный азотная кислота или хлорная кислота, могут разрушать их структуру или вызывать окисление металла.
Какие применения имеют благородные металлы?
Благородные металлы имеют широкий спектр применений. Например, золото используется в ювелирной промышленности, в электронике и в медицине. Платина и ее сплавы используются в катализе, в производстве автомобилей и в медицинских устройствах. Палладий используется в катализаторах и во внутреннем сгорании автомобилей.
Какие особенности взаимодействия благородных металлов с кислотами известны?
Одной из особенностей взаимодействия благородных металлов с кислотами является их стабильность и низкая растворимость в большинстве кислот. Кроме того, благородные металлы могут выступать в роли катализаторов в химических реакциях с кислотами.
