Масса эквивалента сульфата металла — это величина, которая позволяет определить количество металла, содержащегося в сульфате данного металла. Эта химическая величина является важной для расчетов в различных областях химии и техники.
Определение массы эквивалента сульфата металла основано на стехиометрии реакций, в ходе которых происходит образование или растворение сульфата. Для каждого металла существует уникальное значение массы эквивалента сульфата, которое можно использовать для расчетов.
Например, для рассчета массы металла, содержащегося в заданном количестве сульфата, можно использовать следующую формулу: масса металла = масса сульфата * масса эквивалента сульфата металла / масса эквивалента сульфата
Примеры расчета массы эквивалента сульфата металла могут включать различные металлы, такие как натрий, кальций, цинк и многие другие. Для каждого металла существуют конкретные значения массы эквивалента, которые могут быть найдены в химических справочниках или рассчитаны на основе данных о молекулярном весе и стехиометрии реакции.
Что означает масса эквивалента сульфата металла
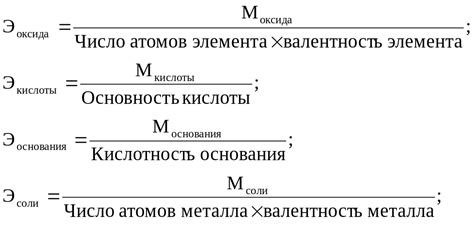
Масса эквивалента сульфата металла - это масса данного сульфата, соответствующая одному эквиваленту металла, содержащемуся в данном сульфате. В химических реакциях масса эквивалента сульфата металла используется для определения количества металла, присутствующего в реакции.
Массу эквивалента сульфата металла можно рассчитать, зная молярную массу сульфата металла. Сначала необходимо определить массовую долю металла в сульфате, которая выражается в процентах. Затем массовая доля металла умножается на молярную массу сульфата металла и делится на 100, чтобы получить массу эквивалента сульфата металла.
Например, для рассчета массы эквивалента сульфата меди (CuSO4), необходимо знать массовую долю меди в этом сульфате, которая составляет 31.86%. Молярная масса CuSO4 составляет 159.61 г/моль. Путем умножения массовой доли меди на молярную массу CuSO4 и деления на 100, получаем массу эквивалента сульфата меди, которая равна 50.79 г/экв.
Знание массы эквивалента сульфата металла позволяет проводить точные расчеты количества металла в различных химических реакциях, а также анализировать его взаимодействие с другими веществами. Это важная химическая величина, которая помогает понять и управлять химическими процессами, связанными с металлами и сульфатами.
Определение понятия "масса эквивалента"
Масса эквивалента – это величина, которая показывает, сколько граммов данного вещества содержится в 1 эквиваленте. Эквивалент – это количество вещества, которое может взаимодействовать с 1 молью водорода (H+) или 1 молью электронов.
Масса эквивалента рассчитывается по формуле: масса эквивалента = молярная масса вещества / степень окисления элемента в реакции.
Для определенных химических веществ, таких как сульфаты металлов, масса эквивалента имеет особое значение. Сульфаты металлов – это соли, состоящие из металла и группы SO4. В реакциях, в которых сульфаты металлов принимают участие, масса эквивалента сульфата металла определяется путем деления молярной массы сульфата металла на степень окисления металла в соответствующей реакции.
Для примера, рассмотрим сульфат меди (CuSO4). Масса эквивалента сульфата меди будет равна молярной массе сульфата меди, деленной на два. Сульфат меди имеет молярную массу примерно 159,6 г/моль, и степень окисления меди в реакциях составляет +2. Поэтому масса эквивалента сульфата меди равна примерно 79,8 г/экв.
Формула расчета массы эквивалента сульфата металла
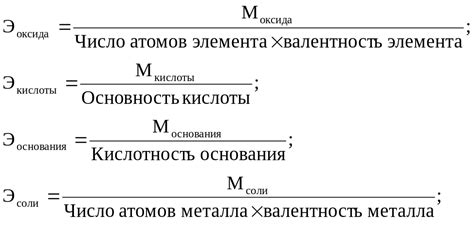
Масса эквивалента сульфата металла позволяет определить количество сульфата, содержащегося в единице вещества данного металла. Для расчета массы эквивалента сульфата металла следует использовать следующую формулу:
Масса эквивалента сульфата металла = масса сульфата металла / заряд иона
Здесь масса сульфата металла обозначает массу вещества, из которого состоит сульфат данного металла, а заряд иона представляет собой электрический заряд иона металла в сульфате. Масса эквивалента сульфата металла измеряется в г/моль.
Пример расчета массы эквивалента сульфата металла можно представить на основе калия. Если масса калия равна 39 г, а его ионный заряд равен 1, то масса эквивалента сульфата калия будет равна:
Масса эквивалента сульфата калия = 39 г / 1 = 39 г/моль
Таким образом, масса эквивалента сульфата калия составляет 39 г/моль, что позволяет определить количество сульфата калия в единице вещества этого металла.
Пример расчета массы эквивалента сульфата металла
Масса эквивалента сульфата металла является важным показателем при проведении различных химических расчетов. Рассмотрим пример расчета массы эквивалента сульфата металла на конкретном примере.
Пусть нам требуется определить массу эквивалента сульфата меди (CuSO4), используя данные о массе пробы этого соединения и числе эквивалентов меди в ней.
Для начала необходимо определить молярную массу сульфата меди CuSO4. Для этого умножим массу атома меди на число атомов меди в молекуле сульфата меди и прибавим к этому произведению массу атома серы, умноженную на число атомов серы в молекуле сульфата меди, и массу атома кислорода, умноженную на число атомов кислорода в молекуле сульфата меди. Результатом будет число, выраженное в г/моль.
Далее, делим массу пробы сульфата меди на молярную массу сульфата меди. Полученное число будет указывать на число молей сульфата меди в пробе. Следующим шагом является определение числа эквивалентов меди (Cu2+) в пробе сульфата меди. Это делается путем умножения числа молей сульфата меди на число эквивалентов меди в молекуле сульфата меди (2).
Наконец, остается только разделить массу пробы сульфата меди на число эквивалентов меди. Полученный результат будет массой эквивалента сульфата меди. Таким образом мы можем определить молекулярную массу вещества и провести различные химические расчеты, основанные на этом показателе.
Значение массы эквивалента сульфата металла в практических приложениях

Масса эквивалента сульфата металла является важным показателем в химических расчетах. Она определяется как масса сульфата металла, которая взаимодействует с единицей валентности. Этот показатель играет ключевую роль при определении количества сульфата металла, необходимого для проведения химических реакций или приготовления растворов.
Значение массы эквивалента сульфата металла может быть использовано в различных практических приложениях. Например, при проведении экспериментов для исследования взаимодействия сульфата металла с другими веществами, знание массы эквивалента позволяет правильно определить количество сульфата металла, которое нужно добавить в смесь или раствор, чтобы достичь необходимого результата.
Определение массы эквивалента сульфата металла также может использоваться для расчета концентрации растворов. Зная массу эквивалента и молярную массу сульфата металла, можно вычислить количество вещества в растворе и определить его концентрацию.
При производстве лекарственных препаратов масса эквивалента сульфата металла также имеет значение. Она может быть использована для определения необходимого количества сульфата металла в составе препарата, чтобы достичь желаемого терапевтического эффекта.
Таким образом, знание значения массы эквивалента сульфата металла является важным инструментом для химиков, и оно применяется во многих практических ситуациях для достижения определенных целей, определения концентрации растворов и производства лекарственных препаратов.
Зависимость массы эквивалента сульфата металла от его химических свойств
Масса эквивалента сульфата металла является важным параметром при расчете и применении данного соединения в химических процессах и аналитических методах. Масса эквивалента определяет содержание активного металла в соединении и является мерой его химической активности.
Зависимость массы эквивалента от химических свойств сульфата металла объясняется его структурой и способностью образовывать соединения с другими веществами. Различные металлы имеют разное число валентных электронов, что влияет на их химическую реактивность.
Например, натрий имеет массу эквивалента 22,99 г/экв, а медь - 31,75 г/экв. Это объясняется тем, что натрий имеет одну валентную электронную оболочку, а медь - две. Соответственно, в единственной молекуле натрия содержится всего один атом металла, а в молекуле меди - два атома.
Кроме того, масса эквивалента сульфата металла зависит от его молекулярного веса. Например, масса эквивалента сульфата меди (CuSO4) будет в два раза больше, чем у серы (SO4), так как сульфат меди состоит из одного атома меди и одного атома серы, а сульфид серы - только из одного атома серы.
Вопрос-ответ
Как определить массу эквивалента сульфата металла?
Масса эквивалента сульфата металла может быть определена путем деления молекулярной массы сульфата металла на число зарядов сульфата.
Какие примеры расчета массы эквивалента сульфата металла можно привести?
Примеры расчета массы эквивалента сульфата металла могут включать сульфат железа, сульфат цинка, сульфат меди и другие соединения.
Какая формула используется для расчета массы эквивалента сульфата металла?
Формула для расчета массы эквивалента сульфата металла имеет вид: масса эквивалента = (молекулярная масса сульфата металла) / (число зарядов сульфата).
Какую роль играет масса эквивалента сульфата металла в химических расчетах?
Масса эквивалента сульфата металла играет важную роль в химических расчетах, таких как определение стехиометрических пропорций реакций и расчет количества реактивов и продуктов.
