Химические реакции происходят вещественные. Они имеют определенную скорость, которая может быть изменена в зависимости от различных факторов. Один из таких факторов - температура. Изучение воздействия температуры на скорость химических реакций является важной частью химических исследований.
Повышение температуры обычно увеличивает скорость химической реакции. Это связано с кинетической теорией, которая утверждает, что при повышении температуры частицы становятся более подвижными и они обладают большей энергией. Большая энергия позволяет молекулам перебороть барьер активации и преодолеть их притяжение друг к другу.
Таким образом, более высокая температура приводит к увеличению коллизий между частицами, ускоряя процесс реакции. Обычно для большинства реакций повышение температуры вдвое приводит к увеличению скорости реакции примерно в два-три раза. Однако, существуют и исключения, когда повышение температуры может вызвать обратный эффект - уменьшение скорости реакции или полное прекращение.
Контроль температуры в химической реакции является важным аспектом при проведении экспериментов и практического применения химических процессов. Понимание влияния температуры на скорость реакции помогает улучшить эффективность работы и оптимизировать процессы, которые требуют точного контроля скорости реакции.
Влияние температуры на скорость реакции

При повышении температуры молекулы вещества получают больше энергии и начинают двигаться быстрее. Увеличение энергии кинетического движения в свою очередь ведет к большему количеству столкновений между молекулами. Чем больше столкновений, тем больше вероятность удачного столкновения с формированием активированного комплекса и дальнейшим образованием продуктов реакции.
Также, увеличение температуры влияет на энергию активации реакции. Энергия активации - это минимальная энергия, необходимая для начала реакции. Увеличение температуры снижает энергию активации, что делает реакцию более легкой и быстрой.
Для количественной оценки влияния температуры на скорость реакции используется уравнение Аррениуса. В этом уравнении скорость реакции зависит от коэффициента реакции и температуры по следующей формуле:
| Уравнение Аррениуса: |
|---|
| скорость реакции = A * exp(-Ea / (R * T)) |
где A - преобразованный предэкспоненциальный множитель, Ea - энергия активации, R - универсальная газовая постоянная, T - температура в Кельвинах.
Из данного уравнения видно, что с увеличением температуры (T) экспонента в знаменателе уменьшается, что приводит к увеличению скорости реакции.
Таким образом, температура играет важную роль в кинетике химических реакций, определяя скорость и эффективность процесса. Повышение температуры может быть использовано для ускорения химических реакций, однако необходимо учитывать, что слишком высокая температура может негативно влиять на стабильность исходных веществ и катализаторов.
Кинетическая теория и реакционная способность
Реакционная способность вещества зависит от энергии активации, которая представляет собой энергию, которую частицы вещества должны преодолеть для того, чтобы претерпеть химическую реакцию. Температура влияет на реакционную способность путем изменения энергии активации.
При повышении температуры, энергия частиц возрастает, что приводит к увеличению вероятности коллизий между частицами и, соответственно, увеличению вероятности успешных реакций. Более высокая энергия частиц также способствует преодолению энергии активации, что позволяет реакции протекать с большей скоростью.
Однако, при очень высоких температурах, возникают и другие эффекты, которые могут привести к снижению скорости реакции. Например, при очень высоких температурах, частицы вещества могут становиться расплывчатыми и неподвижными, что затрудняет их перемещение и коллизии между ними.
Активация молекул и энергия активации
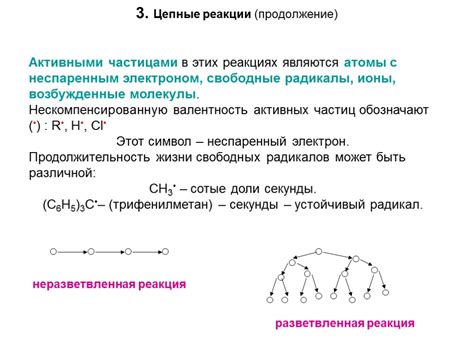
Энергия активации - это энергия, которая необходима для активации молекул и начала реакции. Она представляет собой энергию, которую молекулы должны получить, чтобы преодолеть энергетический барьер. Чем выше энергия активации, тем труднее реакция начинается.
Температура влияет на активацию молекул и энергию активации. При повышении температуры, молекулы получают больше энергии и движутся более быстро. Это позволяет им легче преодолеть энергетический барьер и начать реакцию. Таким образом, при повышении температуры, энергия активации снижается, что способствует увеличению скорости химической реакции.
Например, реакция горения дров медленно протекает при низкой температуре, так как молекулы дров имеют недостаточно энергии для активации. Однако, при повышении температуры (путем добавления источника тепла, такого как спичка), молекулы дров получают достаточно энергии для преодоления энергетического барьера и реакция происходит быстро и энергично.
Зависимость скорости от температуры
Температура играет важную роль в химических реакциях, поскольку она существенно влияет на скорость, с которой протекает процесс.
При повышении температуры частицы вещества получают больше энергии и начинают двигаться быстрее. Это приводит к увеличению частоты столкновений между молекулами, что, в свою очередь, способствует ускорению химической реакции.
Кинетическая энергия молекул, определяющая скорость реакции, пропорциональна температуре в абсолютных единицах. Правило Вант-Гоффа утверждает, что при увеличении температуры на 10 градусов Цельсия скорость химической реакции удваивается (при условии, что другие факторы остаются неизменными).
Однако существует температурный предел, после которого скорость реакции начинает снижаться. Это связано с тем, что при очень высоких температурах частицы становятся слишком "энергичными" и начинают разрушать образующиеся связи, а также ускорение реакции сопровождается значительной генерацией тепла, что может привести к неоднородности системы и ухудшению результатов.
Исходя из зависимости скорости реакции от температуры, большинство химических процессов проводятся при определенной температуре, называемой оптимальной. Поэтому изучение зависимости скорости от температуры имеет важное значение для промышленного производства и практического применения химических реакций.
Эффект температуры на скорость реакции в различных средах

Вода является наиболее распространенной средой, где происходят химические реакции. При повышении температуры водной среды, скорость реакции обычно увеличивается. Это происходит из-за того, что повышение температуры увеличивает энергию молекул, ускоряя их движение и сталкивая их с большей силой. Это, в свою очередь, увеличивает частоту столкновений между реагентами и способствует образованию продуктов реакции.
Однако, в некоторых случаях, повышение температуры может также вызывать изменение характера реакции. Например, при достижении определенной температуры некоторые реакции могут становиться обратимыми. Это означает, что продукты реакции могут декомпозироваться обратно на реагенты под действием повышенной температуры. Также, для некоторых реакций повышение температуры может вызвать изменение пути реакции, что приводит к образованию других продуктов.
Кроме того, температура также может влиять на реакции в нелетучих средах, таких как твердые вещества или жидкости с низкой испаряемостью. В этих средах повышение температуры может привести к увеличению растворимости реагентов и ускорить процессы диффузии. Таким образом, повышение температуры может существенно повлиять на скорость реакции и степень протекания реакции в таких средах.
Однако, следует отметить, что влияние температуры на скорость реакции может быть более сложным, и могут быть исключения из общих правил. В некоторых реакциях низкая температура может способствовать образованию промежуточных продуктов, которые затем могут участвовать в последующих шагах реакции. Таким образом, эффект температуры на скорость реакции может зависеть от конкретного типа реакции и среды, в которой происходит реакция.
- Температура является важным фактором, влияющим на скорость химической реакции.
- В водной среде повышение температуры обычно увеличивает скорость реакции.
- Повышение температуры может также вызвать изменение характера реакции и обратимость процессов.
- Влияние температуры на реакции может быть значительным в нелетучих средах.
- Общие правила могут иметь исключения в зависимости от типа реакции и среды.
Температурная чувствительность реакций
Температурная чувствительность показывает, насколько сильно меняется скорость химической реакции при изменении температуры на определенную величину. Это свойство зависит от термодинамических условий реакции и характера реагирующих веществ.
В общем случае, повышение температуры увеличивает скорость реакции. Это связано с тем, что при повышении температуры возрастает энергия коллизий молекул, что способствует образованию более активных комплексов и увеличению числа удачных столкновений.
Величина температурной чувствительности определяет, как сильно изменяется скорость реакции при изменении температуры. Чем выше значение температурной чувствительности, тем сильнее влияние температуры на скорость реакции.
Температурная чувствительность реакций может быть выражена через уравнение Аррениуса, которое связывает скорость реакции с температурой:
| Уравнение Аррениуса: | ln(k) = ln(A) - (Ea / RT) |
|---|
Где k – скорость реакции, A – преэкспоненциальный множитель, Ea – энергия активации реакции, R – универсальная газовая постоянная, T – температура.
Из уравнения видно, что при увеличении температуры, скорость реакции увеличивается экспоненциально. Это объясняет температурную чувствительность реакций и важность контроля температуры в промышленных и лабораторных условиях. Понимание температурной чувствительности также позволяет оптимизировать условия проведения химических реакций с целью получения максимальной скорости и выхода продукта.
Роль температуры в химических равновесиях
По принципу Ле Шателье, изменения в температуре влияют на равновесную константу и направление реакции. В общем случае, изменение температуры приводит к изменению теплоты реакции, что в свою очередь влияет на равновесную константу.
В зависимости от эндотермической (поглощение тепла) или экзотермической (выделение тепла) природы реакции, изменение температуры может быть включено в систему (теплореактивная реакция) или извлечено из системы (холодореактивная реакция).
Теплореактивные реакции положительно реагируют на повышение температуры, так как повышение температуры приводит к увеличению концентраций продуктов реакции, поднимая равновесие в направлении образования продуктов. По сравнению с этим, холодореактивные реакции негативно реагируют на повышение температуры, так как повышение температуры приводит к увеличению концентраций реагентов и смещает равновесие в направлении реагентов.
Для некоторых реакций, повышение температуры может увеличить процент превращения реагентов в продукты. Это объясняется тем, что повышение температуры обычно увеличивает среднюю энергию частиц, увеличивая частоту успешных столкновений частиц и их энергию активации. В результате чаще осуществляются эффективные столкновения, и реакция происходит быстрее.
| Температура | Равновесная константа | Направление реакции |
|---|---|---|
| Повышение | Увеличение | Продукты |
| Понижение | Уменьшение | Реагенты |
Практическое применение зависимости скорости реакции от температуры
Зависимость скорости химической реакции от температуры имеет большое практическое применение в различных отраслях науки и промышленности.
В промышленности эта зависимость используется для ускорения или замедления химических процессов. Например, в производстве сырья и материалов, таких как стекло, полимеры или сплавы, контроль температуры позволяет оптимизировать процесс получения продукта. Повышение температуры может значительно увеличить скорость различных химических превращений, что позволяет существенно сократить время производства и увеличить выход продукции.
Зависимость скорости реакции от температуры также применяется в технологии катализа. Катализаторы - вещества, ускоряющие химические реакции - работают на определенной температуре, которая оптимизирует их активность. Знание зависимости скорости реакции от температуры позволяет выбирать наиболее эффективные катализаторы и настраивать параметры реакций для получения оптимального результата.
В области разработки лекарственных препаратов, где одна из задач - получение активных веществ в больших количествах, контроль температуры является важным фактором. Изменение температуры может существенно влиять на скорость синтеза и конверсии веществ, что позволяет ускорять или замедлять их получение.
Кроме того, знание зависимости скорости реакции от температуры широко используется в научных исследованиях. Использование различных температурных условий позволяет изучать кинетику реакций, определять механизмы и исследовать влияние факторов на химические процессы.
Таким образом, практическое применение зависимости скорости реакции от температуры находится множестве отраслей и играет важную роль в оптимизации процессов и получении желаемых продуктов.




