Вода - одно из самых распространенных веществ на Земле. Ее уникальные свойства делают ее незаменимой в ряде процессов, включая химические реакции, биологические процессы и образование и разрушение горных пород. Одной из причин таких свойств воды является ее способность действовать как отличный растворитель.
Факторы, которые влияют на способность воды растворять молекулы и атомы, включают ее полярность и способность образовывать водородные связи. Вода состоит из двух атомов водорода и одного атома кислорода, и каждый из этих атомов имеет заряд. Атомы водорода несут положительный заряд, а атом кислорода - отрицательный заряд. Этот дисбаланс зарядов делает молекулу воды полюсной, что означает, что она имеет отрицательную и положительную части.
Полярность молекулы воды также позволяет ей образовывать водородные связи с другими молекулами. Водородная связь - это слабая электростатическая связь между молекулой воды и другой молекулой. Это взаимодействие позволяет воде притягивать и удерживать молекулы других веществ, что делает ее отличным растворителем для широкого спектра веществ.
Вода: особенности растворения и структуры

Основой процесса растворения является способность молекул воды образовывать водородные связи. Вода состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентными связями. Эти атомы образуют угловидную структуру, в которой атомы кислорода являются отрицательно заряженными, а атомы водорода - положительно заряженными.
За счет водородных связей вода образует устойчивую и упорядоченную структуру. Каждая молекула воды может образовывать до четырех водородных связей с другими молекулами воды, что приводит к образованию сети или "сетчатой" структуры.
| Химическое свойство | Описание |
|---|---|
| Полярность | Вода является полярным растворителем, что позволяет ей легко растворять полярные вещества, такие как сахар или соль. Отрицательно заряженные кислородные атомы притягивают положительные ионы, а положительные водородные атомы - отрицательные ионы. |
| Высокая теплоемкость | Вода имеет высокую теплоемкость, что позволяет ей поглощать и отдавать большое количество тепла без сильного изменения своей температуры. Это свойство важно для поддержания стабильной температуры в природных экосистемах. |
| Высокая теплопроводность | Вода обладает высокой теплопроводностью, что позволяет ей эффективно распределять тепло по всему объему. Это важно для поддержания теплового баланса в организме и поддержания стабильной температуры. |
Структура и свойства воды делают ее незаменимым средством для жизни на Земле. Они обеспечивают растворение и транспорт веществ в организмах, а также поддержание стабильных условий в окружающей среде.
Уникальность растворителя
Первое особое свойство воды - ее способность образовывать водородные связи. Молекулы воды состоят из атома кислорода, связанного с двумя атомами водорода. Эти атомы водорода имеют положительный заряд, а атом кислорода - отрицательный заряд. Такая разность зарядов позволяет молекулам воды притягивать друг друга, образуя водородные связи. Эти связи делают воду жидкой при комнатной температуре, а также позволяют ей образовывать сильные взаимодействия с другими молекулами и ионами.
Второе особое свойство воды - ее высокая теплоемкость. За счет водородных связей между молекулами, вода может поглощать и отдавать большое количество тепла, не претерпевая значительных изменений в своей температуре. Это делает воду отличным средством охлаждения и нагрева, а также позволяет ей поддерживать стабильную температуру в океанах и озерах, создавая благоприятные условия для существования жизни.
Третье особое свойство воды - ее высокая поверхностная напряженность. Водородные связи между молекулами воды создают высокую силу притяжения на поверхности жидкости. Это приводит к тому, что вода может образовывать капли и пузырьки, а также поддерживать определенную форму. Такое свойство играет важную роль в живых организмах, например, позволяет растениям поднимать воду по стеблю и листьям.
Влияние температуры на свойства растворения
Это связано с изменением энергии движения молекул вещества. При повышении температуры молекулы получают дополнительную энергию, что способствует разрушению межмолекулярных связей и увеличению свободного объема для движения молекул растворенного вещества.
При снижении температуры энергия движения молекул снижается, что приводит к уменьшению свободного объема и усилению взаимодействия между растворителем и растворенным веществом. В результате растворимость может снижаться или даже достигать насыщения, при котором некоторое количество растворенного вещества не растворяется вообще.
Таким образом, температура играет роль в регулировании растворимости вещества в растворителе. Это явление широко используется в химических процессах, например, при приготовлении растворов с заданной концентрацией или при проведении реакций с выделением тепла или поглощением.
Межмолекулярные силы воды и их роль в растворении
Основными межмолекулярными силами воды являются:
- Водородные связи – слабые химические связи между водными молекулами. Каждая молекула воды способна образовать до четырех водородных связей – две акцепторные и две донорные. Эти связи обеспечивают согласованное движение молекул воды и создают ее высокое кипящее и плавление температуры.
- Ван-дер-Ваальсовы взаимодействия – слабые силы, обусловленные временными изменениями электронного облака водных молекул. Они отвечают за атомные связи между атомами воды и способствуют взаимопритяжению молекул воды.
- Гидрофобные взаимодействия – взаимодействия между гидрофобными (неполярными) частями молекулы воды и неполярными растворителями. Они помогают размешивать и растворять гидрофобные вещества в воде.
Эти межмолекулярные силы обеспечивают устойчивость структуры воды и определяют ее способность к растворению различных веществ.
Вода может растворять как поларные, так и неполярные молекулы. Поларные молекулы растворяются благодаря образованию водородных связей с молекулами воды. Неполярные молекулы растворяются за счет ван-дер-Ваальсовых взаимодействий с молекулами воды.
Таким образом, межмолекулярные силы воды являются основой процесса растворения различных веществ в воде. Благодаря этим силам, вода позволяет поддерживать жизнь на Земле, обеспечивая необходимую среду для биологических процессов.
Водородные связи и их влияние на структуру воды
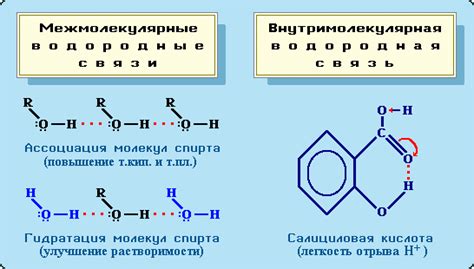
Водородные связи дают воде определенную структуру, образуя так называемые водные клатраты или кластеры. Каждая молекула воды может иметь восемь водородных связей – по две с каждой соседней молекулой. Эти связи образуются в результате притяжения между частично заряженными положительно и отрицательно заряженными атомами водных молекул.
Водородные связи воды обеспечивают ее высокую коэрентность и способность образовывать структуры с определенными свойствами. Они делают воду жидкостью с высокой тепловой устойчивостью и позволяют ей сохранять свою жидкую форму при относительно низких температурах.
Водородные связи также отвечают за поверхностное натяжение воды, что приводит к явлению капиллярности. Это свойство позволяет воде подниматься по узким трубкам против силы тяжести и обеспечивает транспорт воды в растениях и живых организмах.
Водородные связи также играют важную роль в биологических системах. Они являются основой для образования двухцепочечной структуры ДНК и РНК и обеспечивают стабильность межмолекулярных комплексов белков.
Таким образом, водородные связи являются ключевым фактором, определяющим структуру и свойства воды. Изучение этих связей позволяет лучше понять особенности и уникальность воды как растворителя и жизненно важного вещества.
Структура кристаллической льда
Вода в жидком состоянии не имеет определенной структуры, и молекулы воды могут двигаться и взаимодействовать свободно. Однако при охлаждении до температуры ниже 0 °C вода начинает образовывать связанные кластеры, которые последовательно погружаются в трехмерную трещину, образуя кристаллическую структуру кристаллической льда.
Кристаллический лед образует семь различных структурных фаз, но наиболее распространенной и хорошо изученной является структура под названием льда Ih. В структуре льда Ih молекулы воды образуют гексагональные кластеры, соединенные друг с другом через водородные связи.
Структура кристаллической льда Ih состоит из упорядоченных слоев, в которых молекулы воды организованы в шестиугольные кластеры. Каждая молекула воды в кластере связана с пятью другими молекулами воды через водородные связи. Эти слои кристаллической структуры льда Ih формируютс
Аморфность и свойства воды в жидком состоянии

В отличие от большинства других жидкостей, вода не имеет фиксированного расстояния между молекулами. Вместо этого, молекулы воды свободно перемещаются и переупорядочиваются, образуя различные структуры в течение короткого времени.
Аморфность воды обусловлена ее полиароматичностью, то есть способностью молекулы воды образовывать множество взаимосвязей с другими молекулами. Это приводит к тому, что вода может образовывать сложные микроструктуры, которые могут меняться на молекулярном уровне.
Благодаря аморфности, вода обладает такими удивительными свойствами, как высокая теплоемкость, высокая теплопроводность, высокая вязкость и поверхностное натяжение. Кроме того, аморфная структура воды позволяет ей быть отличным растворителем для множества веществ.




