Серный оксид – неорганическое соединение, которое имеет множество свойств и способностей к химическим реакциям. Этот соединитель известен своей способностью взаимодействовать с различными веществами и оказывать на них определенное воздействие. Рассмотрим некоторые из этих реакций, чтобы лучше понять свойства серного оксида и его возможное применение.
Серный оксид может проявлять кислотные свойства и взаимодействовать с основаниями. При реакции с щелочными растворами он образует соль серной кислоты. Это важное свойство находит применение в промышленности, в процессе производства различных химических соединений и материалов.
Кроме того, серный оксид может проявлять окислительные свойства и взаимодействовать с различными веществами. Например, он может окислять неорганические соединения, такие как хлориды и сульфиды, превращая их в соответствующие окислители или серные кислоты.
Также стоит отметить, что серный оксид может реагировать с органическими соединениями. В результате таких реакций возникают сложные химические соединения, которые могут быть использованы в различных отраслях промышленности, таких как производство пластмасс, лакокрасочных материалов и многих других.
Таким образом, серный оксид является важным реагентом, обладающим широким спектром возможностей в химических реакциях. Его способность взаимодействовать с различными веществами делает его ценным компонентом в процессе производства и создания новых соединений и материалов.
Серный оксид и его свойства

Физические свойства:
- Серный оксид обладает резким, едким запахом.
- Он является безцветным газом, однако при высокой концентрации может приобретать сероватый цвет.
- Серный оксид обладает хорошей растворимостью в воде, что позволяет ему эффективно взаимодействовать с различными веществами.
- При низкой температуре серный оксид может превращаться в твердое вещество, называемое диоксид серы (SO3).
Химические свойства:
- Серный оксид является окислителем и может вступать в реакции с различными веществами.
- Он реагирует с водой, образуя сульфиты и сульфаты, которые находят применение в производстве.
- Серный оксид образует кислоты с различными соединениями, например, с оксидами щелочных металлов.
- Он может вступать в реакцию с аммиаком, образуя сульфат аммония, который используется в сельском хозяйстве в качестве удобрения.
Серный оксид – вещество, которое способно взаимодействовать с множеством других веществ и играет важную роль в различных областях промышленности и научных исследований. Изучение его свойств и реакций позволяет расширить наши знания о химии и применить их для решения конкретных задач.
Физические свойства серного оксида
Серный оксид является достаточно плотным газом, его плотность равна 2.926 г/л. Он легче воздуха и имеет молекулярный вес равный 64.1 г/моль. Серный оксид является плохим проводником электричества.
SO2 хорошо растворим в воде, образуя сульфиты и сульфаты. Он также хорошо растворим в серной кислоте и растворах щелочей. Серный оксид является прекурсором для получения других серных соединений, таких как сульфированные органические соединения и серную кислоту.
Химические свойства серного оксида

Химические свойства серного оксида делают его активным и реактивным соединением. Он легко вступает во множество химических реакций и взаимодействий с другими веществами. Рассмотрим основные виды взаимодействий серного оксида.
- Взаимодействие с водой: Серный оксид может растворяться в воде, образуя серную кислоту (H2SO3). Этот процесс является реакцией окисления, в результате которой серный оксид переходит в серную кислоту.
- Взаимодействие с щелочами: Серный оксид проявляет химическую активность при взаимодействии с щелочами, такими как натрий или калий. Это реакция нейтрализации, при которой серный оксид и щелочные вещества превращаются в сульфаты.
- Взаимодействие с щелочными металлами: При взаимодействии с щелочными металлами, такими как натрий или калий, серный оксид может образовывать сернистые соли. Это реакция описывается как образование соответствующего сульфита.
- Взаимодействие с соединениями серы: Серный оксид может реагировать с другими соединениями серы, образуя сложные сернистые соединения. Этот процесс часто применяется в производстве различных химических соединений и приготовлении аналитических реактивов.
Химические свойства серного оксида делают его важным объектом изучения в области химии. Его реактивность и способность образовывать различные соединения открывают широкие возможности для его использования в промышленности и научных исследованиях.
Взаимодействие серного оксида с водой
Серный оксид (SO2) взаимодействует с водой, образуя серную кислоту (H2SO3) и общую формулировку реакции можно представить следующим образом:
SO2 + H2O → H2SO3
Эта реакция происходит при наличии катализаторов или при повышенной температуре. При взаимодействии серного оксида с водой образуется серная кислота, которая может быть использована в промышленности в качестве сырья для производства различных химических соединений и удобрений.
Конечная продукция реакции, серная кислота, обладает сильными кислотными свойствами и применяется в различных отраслях промышленности, в том числе в производстве бумаги, кожи, текстиля и удобрений. Кроме того, она может использоваться в качестве катализатора при реакциях полимеризации и оксидации органических соединений.
Взаимодействие серного оксида с кислородом
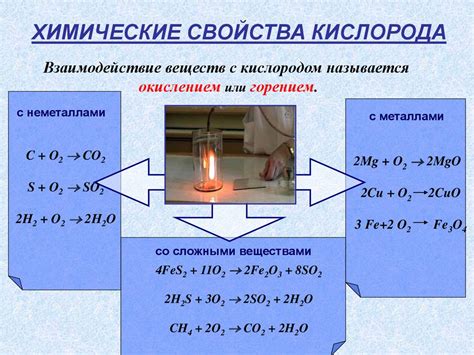
Серный оксид (SO2) может взаимодействовать с кислородом при различных условиях. В результате такого взаимодействия образуются различные соединения серы и кислорода.
Комбинирование серного оксида и кислорода может привести к образованию серного триоксида (SO3). Это соединение является одной из основных составляющих серной кислоты (H2SO4).
В реакции взаимодействия серного оксида и кислорода могут участвовать и другие вещества. Например, в присутствии катализаторов, таких как оксиды ванадия или платины, может происходить окисление SO2 до SO3 в газовой фазе.
Взаимодействие кислорода и серного оксида также может происходить в водной среде. В этом случае образуется серный ангидрид (H2SO3), который входит в состав серной кислоты.
Благодаря способности серного оксида и кислорода вступать во взаимодействие, эти вещества широко используются в промышленности и химической лаборатории для получения различных серных соединений и оксидов.
| Вещество | Реакция |
|---|---|
| SO2 | O2 → SO3 |
| SO3 | H2O → H2SO4 |
| SO2 + O2 | В присутствии катализаторов: SO2 + O2 → SO3 |
| SO2 | H2O → H2SO3 |
Взаимодействие серного оксида с щелочами
При взаимодействии серного оксида с щелочами происходят следующие реакции:
- SO2 + NaOH → Na2SO3 + H2O
- SO2 + KOH → K2SO3 + H2O
Эти реакции являются нейтрализационными и происходят с образованием солей – сульфитов щелочных металлов, а также воды.
Серный оксид также может взаимодействовать с карбонатами щелочных металлов:
- SO2 + Na2CO3 → Na2SO3 + CO2
- SO2 + K2CO3 → K2SO3 + CO2
В этом случае образуется сульфит и выделяется углекислый газ.
Таким образом, серный оксид способен реагировать с щелочами, образуя сульфиты металлов и воду либо углекислый газ, в зависимости от вещества, с которым он вступает во взаимодействие.
Взаимодействие серного оксида с кислотами
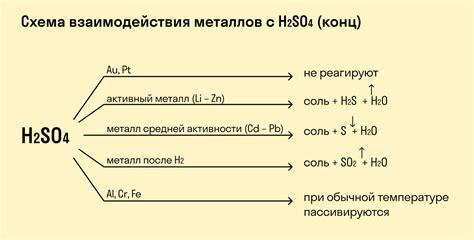
Серный оксид (SO2) может взаимодействовать с различными кислотами, образуя соответствующие соли или кислотные анионы. Это взаимодействие происходит через реакцию окисления серного оксида, при которой он принимает электроны от кислоты.
При взаимодействии с кислородной кислотой, например, серным оксидом может образовываться сульфатный ион (SO42-). Это происходит следующим образом:
SO2 + H2SO4 → H2SO3 (сернистая кислота) + H2O
Сернистая кислота (H2SO3) может дальше реагировать, образуя сульфатные соли:
H2SO3 + NaOH → NaHSO3 (натриевая сернистокислая соль) + H2O
При образовании сульфатного иона происходит окисление серного оксида, при этом сам оксидируется до сернистой кислоты.
Кроме этого, серный оксид может также взаимодействовать с другими кислотами, такими как хлороводородная кислота (HCl) или азотная кислота (HNO3). Результатом этих реакций являются соответствующие кислотные анионы, такие как хлоридные или нитратные ионы.
Взаимодействие серного оксида с кислотами имеет важные промышленные и экологические последствия. Например, серный оксид является основным компонентом промышленных выбросов от сжигания ископаемого топлива, которые взаимодействуют с атмосферными водяными парами, образуя серную кислоту и повышая кислотность в атмосфере. Эта реакция рассматривается как основная причина кислотного дождя.
Использование серного оксида в промышленности
Производство кислорода: Серный оксид является ключевым компонентом в процессе производства кислорода по методу Линде. Он применяется для осушки входящего воздуха и удаления из него углекислого газа и воды. Благодаря своей высокой реактивности, серный оксид обеспечивает эффективный и быстрый процесс разделения кислорода.
Производство синтетических материалов: Серный оксид используется при производстве синтетических материалов, таких как резина, нейлон, полиэстер и полиуретан. Он является важным ингредиентом для получения определенных структурных и химических свойств этих материалов, придавая им прочность, упругость и устойчивость к износу.
Очистка газовых выбросов: Серный оксид используется в промышленности для очистки газовых выбросов от сероводорода и других серосодержащих соединений. Он реагирует с сероводородом, образуя нерастворимый серный осадок, который затем можно удалить из газового потока. Это помогает снизить выбросы серных соединений в атмосферу и уменьшить негативное влияние на окружающую среду.
Производство специализированной химии: Серный оксид является важным ингредиентом в производстве различных специализированных химических соединений. Он широко используется в процессах синтеза оксида серы, сульфатов, сульфитов и других серосодержащих соединений. Эти соединения находят применение в различных отраслях, включая фармацевтику, пищевую промышленность и производство удобрений.
Использование серного оксида в промышленности продолжает расширяться, поскольку его уникальные свойства и реактивность делают его незаменимым компонентом для многих производственных процессов. Благодаря этому соединению, множество отраслей получают высокую эффективность, качество и устойчивость своей продукции.




