Галогены - это группа химических элементов, которая включает фтор, хлор, бром, йод и астат. Они обладают высокой реактивностью и активностью в химических реакциях, поэтому они встречаются в природе только в виде соединений. Это означает, что галогены не находятся в свободном состоянии на Земле, а всегда связаны с другими атомами или молекулами.
Одной из основных причин, по которой галогены образуют соединения, является их высокая электроотрицательность. Галогены имеют высокую способность притягивать электроны, что делает их очень реактивными. Они стремятся компенсировать свою высокую электроотрицательность путем нахождения и связи с атомами других элементов, что приводит к образованию соединений.
Галогены также обладают высокой энергией связи, что делает их нестабильными и склонными к реакциям. Они могут образовывать сильные химические связи с другими атомами, что приводит к образованию различных соединений. Эта способность галогенов образовывать стабильные соединения делает их полезными в различных областях, таких как фармацевтика, химия и промышленность.
Таким образом, галогены встречаются в природе только в соединениях из-за их высокой реактивности, электроотрицательности и энергии связи. Эти химические свойства делают галогены важными элементами в химических реакциях и широко используемыми в различных областях науки и промышленности.
Галогены: природные соединения
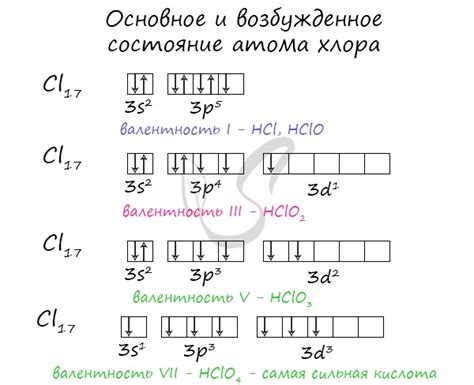
Галогены обладают высокой реактивностью, что делает их неподходящими для существования в свободном состоянии в природе. Они обладают семью электронами в своей внешней электронной оболочке, из которых семь электронов занимают п-орбиталь, позволяя им образовывать соединения с другими элементами.
Фтор, хлор, бром и иод являются распространенными в природе и широко встречаются в различных соединениях. Фтор, например, может быть обнаружен в виде плавленых солей в морской воде и в зубной эмали животных. Хлор также может быть найден в морской воде, пресных озерах и даже в некоторых растениях.
Бром встречается в морской воде, некоторых озерах, минералах и месторождениях соли. Иод, в свою очередь, находится в морских водорослях и рыбе. Астат - самый редкий элемент группы, и его соединения в природе очень редки.
Соединения галогенов имеют различные применения в различных областях человеческой жизни. Например, хлор используется для очистки питьевой воды, фтор используется в зубных пастах и астат может быть использован в медицинских исследованиях.
Таким образом, галогены встречаются в природе только в соединениях, и их присутствие в различных источниках является важным для множества процессов на Земле.
Химические свойства галогенов
В природе галогены встречаются исключительно в виде соединений. Это связано с их высокой реакционностью и склонностью к образованию ионов. Они имеют семь электронов во внешней электронной оболочке и стремятся заполнить ее, получив октет. Для достижения стабильного состояния, галогены образуют соединения с другими элементами, включая металлы.
Галогены могут образовывать соединения с различными веществами, их реактивность расширяется от фтора к йоду. Фтор является самым реакционным галогеном, который образует соединения со многими элементами, включая неплотнокодированные металлы и даже инертные газы. Хлор, бром и йод также образуют различные соединения, но их активность снижается по мере увеличения атомного радиуса.
Галогены образуют соли с металлами, такие как хлориды, бромиды и йодиды. Эти соединения широко распространены в природе и имеют множество применений в промышленности, медицине и других отраслях. Также галогены образуют соединения с водородом, известные как галогеноводороды, которые имеют значительное применение в химической промышленности.
- Фтор может образовывать соединения с почти всеми известными элементами.
- Хлор образует хлориды, которые широко используются в производстве пластиков, отбеливателей и дезинфицирующих средств.
- Бром применяется в фотографии, производстве огнезащитных материалов и лекарств.
- Йод используется в медицине, производстве красителей и как антисептик.
Химические свойства галогенов связаны с их высокой реакционностью и способностью образовывать соединения с другими элементами. Их различные соединения имеют многообразные применения и играют важную роль в жизни человека и окружающей среды.
Частота встречаемости галогенов в природе
Причина такой частоты встречаемости галогенов в соединениях – их высокая химическая активность. Галогены обладают семью электронов в своей внешней энергетической оболочке, и им недостает всего одного электрона для заполнения этой оболочки. Из-за этого, галогены очень легко вступают в химические реакции и образуют стабильные соединения с другими элементами.
Самым распространенным галогеном в природе является хлор, которое встречается в виде хлоридов, таких как хлорид натрия (NaCl). Хлорид натрия можно найти в морской воде, в горных породах и в почве. Бром и йод также встречаются в виде соединений, таких как бромиды и йодиды, которые часто присутствуют в морской воде и горных породах.
Фтор, самый реактивный галоген, в природе встречается в основном в виде фторидов, таких как кальция фторид (CaF2). Фторид кальция является одним из основных компонентов почв и минеральных отложений.
Астат, самый редкий галоген, встречается в природе в очень малых количествах и его соединения практически неизвестны.
| Галоген | Примеры встречаемых соединений |
|---|---|
| Фтор | Фторид кальция (CaF2), фторид алюминия (AlF3) |
| Хлор | Хлорид натрия (NaCl), хлорид калия (KCl) |
| Бром | Бромид калия (KBr), бромид натрия (NaBr) |
| Иод | Иодид калия (KI), иодид натрия (NaI) |
| Астат | Соединения астата известны в очень малых количествах |
Физические свойства галогенов
Во-первых, галогены представляют собой неметаллы, которые обычно находятся в газообразном или жидком состоянии при комнатной температуре. Фтор является газом, хлор обычно подается в виде газа или жидкости, а бром - в виде жидкости. Температура иода и астата, хотя и выше комнатной температуры, все равно позволяет сохранить их в жидком состоянии.
Во-вторых, галогены обладают высокой электроотрицательностью, что делает их сильными окислителями. Они могут легко принимать электроны от других веществ, образуя отрицательно заряженные ионы. Это делает галогены очень реакционноспособными и способными образовывать различные соединения с другими элементами.
Также галогены обладают высокой атомной массой и плотностью. Например, плотность фтора составляет около 1,7 г/см³, хлора - около 3,2 г/см³, брома - около 3,1 г/см³, иода - около 4,9 г/см³, астата - около 7 г/см³. Эти свойства делают галогены тяжелыми элементами с относительно большой массой в сравнении с другими элементами периодической системы.
Галогены также обладают высокой теплоемкостью и теплопроводностью. Они обладают хорошей проводимостью электричества и тепла, а также устойчивы к высоким температурам.
Это некоторые из физических свойств галогенов, которые делают их уникальными и важными в химии и других областях науки.
Образование соединений галогенов в природе

Соединения галогенов образуются в природе через различные химические процессы. Одним из основных источников этих соединений является морская вода. Большинство галогенов в океанах присутствуют в виде ионов, таких как фториды, хлориды, бромиды и йодиды. Они образуются в результате солевых отложений и атмосферных осадков.
Фториды являются наиболее распространенными соединениями галогенов в природе. Фториды встречаются в земных породах, растениях и животных. Они присутствуют в значительном количестве во фторитах и флюорапатитах. Поступая в организмы живых существ, фториды выполняют важную роль в формировании зубной эмали и защите от кариеса.
Хлориды также имеют широкое распространение в природе. Они содержатся в морской воде, водных растворах, растениях и животных. Хлориды играют важную роль в поддержании осмотического давления и баланса электролитов в организмах животных и человека.
Бромиды встречаются в океанах, соленых озерах и морских растениях. Они имеют разнообразные функции в биологических системах и медицине. Бромиды использовались в прошлом как успокоительные средства, однако в настоящее время их применение ограничено.
Йодиды также можно найти в морской воде, морских растениях и горных породах. В организме человека йодиды необходимы для функционирования щитовидной железы и поддержания ее гормонального баланса.
Образование соединений галогенов в природе происходит через сложные химические реакции и процессы, связанные с геологическими, биологическими и атмосферными факторами. Соединения галогенов играют важную роль в природных системах и жизни организмов, выполняя различные функции.
Влияние окружающей среды на соединения галогенов
Однако в природе галогены встречаются только в соединениях. Это связано с их высокой реакционной способностью и нестабильной природой, из-за которых они не могут существовать в чистом виде. Галогены очень растворимы в воде и могут легко образовывать с молекулами вещества разнообразные химические соединения.
Окружающая среда также оказывает влияние на соединения галогенов. Например, воздух, вода, почва и другие факторы могут приводить к разложению ионов галогенов и образованию новых соединений. Взаимодействие галогенных соединений с окружающей средой может приводить к образованию токсичных веществ и загрязнению окружающей среды.
Из-за своего высокого влияния на окружающую среду и опасности для здоровья человека, галогены часто используются в промышленности и научных исследованиях с особыми мерами предосторожности. Такие соединения, как фториды и хлориды, широко применяются в производстве пластмасс, лекарств, пестицидов и других химических продуктов, но контроль и управление их использованием очень важны для предотвращения негативных последствий для окружающей среды и человечества.
Применение галогенов в технологии
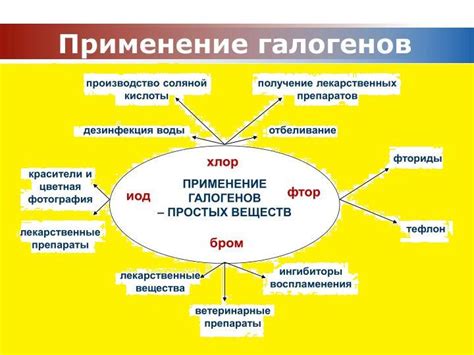
Во-первых, галогены используются в процессе производства полимерных материалов. Например, перфторинированные полимеры, содержащие фтор, обладают высокой химической стойкостью и используются в производстве прочных и гибких пленок, покрытий и трубок.
Во-вторых, галогены применяются в электронной промышленности. Хлор, фтор и бром используются в качестве реагентов для получения полупроводниковых материалов, таких как кремний, германий и галлий-арсенид. Это позволяет создавать электронные компоненты с высокой эффективностью и стабильностью работы.
Кроме того, фтор и йод широко используются в производстве различных химических соединений. Фтор используется в получении фторида водорода, который является основным сырьем для производства фторорганических соединений. Йод используется в производстве йодированной соли и медицинских препаратов.




