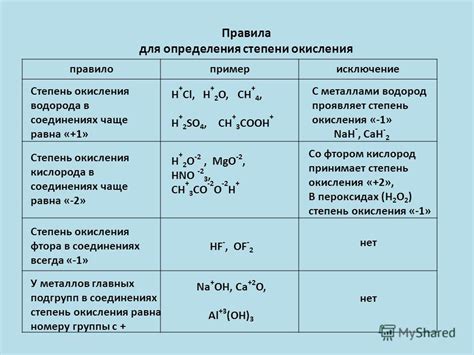
Степень окисления, или валентность, является одним из важных понятий в химии. Она позволяет определить, какой заряд имеет атом в молекуле, и является условным показателем его "силы" или электроотрицательности. Степень окисления помогает нам понять, как атомы связаны друг с другом и как происходят химические реакции.
Когда атом связывается с другими атомами в молекуле, он может отдавать или принимать электроны. В процессе образования химических связей атом повышает или понижает свой энергетический уровень, изменяя свою степень окисления. Степень окисления указывает на разницу между числом электронов, образующих атом, и его возможным идеальным числом электронов в соответствии с валентной электронной конфигурацией.
Простыми словами, степень окисления говорит о том, сколько электронов атом либо потерял, либо получил, чтобы стать стабильным. Положительная степень окисления указывает на дефицит электронов, так как атом отдал их, а отрицательная степень окисления показывает, что атом принял дополнительные электроны. Степень окисления атомов в молекуле суммируется в рамках химической формулы, что делает ее электрически нейтральной.
Степень окисления: условный заряд атома
Когда атом теряет электрон(ы), его степень окисления становится положительной. Например, если натриевый атом отдает электрон, его степень окисления будет +1. Если атом принимает электрон(ы), его степень окисления становится отрицательной. Например, кислородный атом, принимающий два электрона, будет иметь степень окисления -2.
Степень окисления атома в молекуле зависит от его электроотрицательности и количества электронов в его валентной оболочке. Чтобы определить степень окисления атома, необходимо учитывать его связи с другими атомами в молекуле.
Степень окисления играет важную роль в химических реакциях, поскольку позволяет установить, какие атомы в молекуле подвергаются окислению, а какие – восстановлению. Знание степеней окисления помогает понять, какие вещества могут служить окислителями, а какие – восстановителями, и предсказать их реакционную активность.
Неизмененный заряд атома в молекуле
Когда атом образует химическую связь, его электроны могут быть смещены в направлении другого атома или группы атомов. Однако, это не всегда ведет к изменению заряда атома в молекуле. В некоторых случаях заряд атома остается неизменным и это может иметь важные физические и химические последствия.
Неизмененный заряд атома означает, что атом не теряет и не получает электроны при образовании связи. Это может быть результатом компенсации положительного и отрицательного зарядов в молекуле. Например, в молекуле воды (H2O) кислородный атом притягивает электроны от водородных атомов, но заряд кислорода остается неизменным. Это происходит из-за разделения зарядов между атомами, создавая так называемую полярную связь.
Неизмененный заряд атома в молекуле может иметь важное значение для его реактивности и способности образовывать связи с другими атомами. Например, металлы часто образуют ионы с постоянным зарядом и положительную степень окисления, что обуславливает их способность обмениваться электронами. В то же время, неметаллы могут образовывать химические связи с неизмененным зарядом, что определяет их физические и химические свойства.
Понимание неизмененного заряда атома в молекуле помогает ученым объяснить различные химические процессы и реакции, а также способствует разработке новых материалов и составов с определенными физическими и химическими свойствами.
Условный заряд атома

Условный заряд атома, также известный как степень окисления, представляет собой особую характеристику атома в молекуле. Он определяет, сколько электронов атом получил или потерял при образовании химической связи.
Условный заряд позволяет упростить описание химических реакций и принять формализованный подход к расчету баланса электронов. Он играет ключевую роль в определении силы и направления химических связей между атомами в молекуле.
Для определения условного заряда атома необходимо знать его электроотрицательность. Атомы с большей электроотрицательностью имеют отрицательный условный заряд, так как они привлекают электроны к себе сильнее, чем атомы с меньшей электроотрицательностью.
Таблица Менделеева может быть использована для определения условных зарядов атомов различных элементов. В таблице указаны электроотрицательности элементов, которые позволяют нам определить их условные заряды.
| Элемент | Электроотрицательность | Условный заряд |
|---|---|---|
| Кислород | 3.5 | -2 |
| Водород | 2.1 | +1 |
| Хлор | 3.0 | -1 |
| Азот | 3.0 | -3 |
Условный заряд атома в молекуле может быть положительным или отрицательным числом, в зависимости от того, сколько электронов он получил или потерял. Например, кислород обычно имеет условный заряд -2, так как он принимает 2 электрона от других атомов. С другой стороны, водород имеет условный заряд +1, так как он отдает свой единственный электрон.
Понимание условного заряда атома является ключевым фактором при изучении химических реакций и построении химических формул. Он помогает определить количество электронов, участвующих в химической реакции, и позволяет предсказывать формирование новых химических связей.
Значение степени окисления
Значение степени окисления также позволяет определить типы связей в молекуле и установить, какие атомы находятся в окислительном или восстановительном состоянии. Благодаря этой информации можно предсказать, какие реакции будут происходить между атомами и какие продукты образуются.
Использование степени окисления помогает упростить изучение химических реакций и понять их характеристики. Это позволяет нам более эффективно проектировать и синтезировать новые соединения, а также разрабатывать стратегии для оптимизации химических процессов.
Формула определения степени окисления
Формула определения степени окисления для атома в молекуле выглядит следующим образом:
Степень окисления = количество электронов, которые атом получает - количество электронов, которые атом отдаёт.
Знак "+" указывает на то, что атом получает электроны, а знак "-" - что атом отдаёт электроны. Степень окисления может быть положительной, отрицательной или равной нулю.
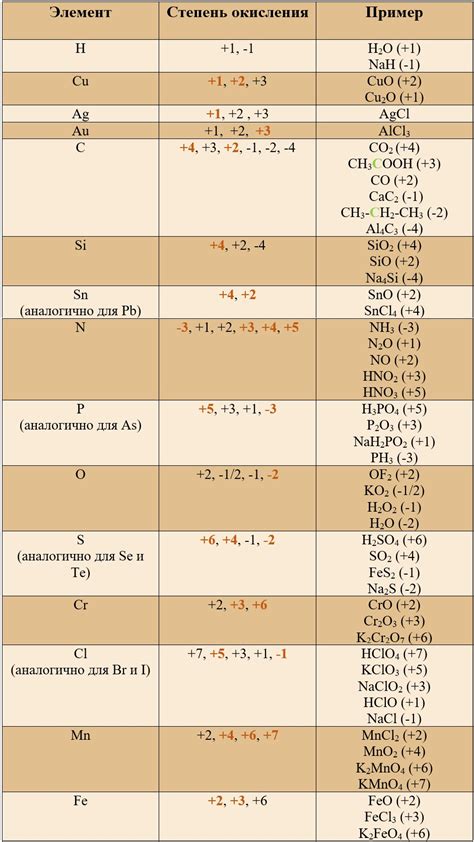
Степень окисления атома вещества определяется в соответствии с его электронной конфигурацией и правилами нумерации степеней окисления.
Зная степень окисления атома, можно анализировать его химическое поведение, предсказывать его способность к реакциям и определять тип химической связи, которую атом образует с другими атомами.
Таким образом, фор-мула определения степени окисления позволяет изучать и понимать химические процессы и свойства молекул в химии.
Примеры степени окисления
1. Вода (H2O)
В молекуле воды каждый атом водорода имеет степень окисления +1, а атом кислорода имеет степень окисления -2. Это связано с тем, что атомы водорода отдают один электрон атому кислорода, образуя полярную ковалентную связь.
2. Серная кислота (H2SO4)
В молекуле серной кислоты каждый атом водорода имеет степень окисления +1, а атом серы имеет степень окисления +6. Каждый атом кислорода имеет степень окисления -2. Это связано с тем, что атомы водорода отдают свои электроны атому серы, а атомы кислорода получают электроны от атомов серы.
3. Фторид кальция (CaF2)
В молекуле фторида кальция атом кальция имеет степень окисления +2, а атом фтора имеет степень окисления -1. Это связано с тем, что атом кальция отдает два электрона атому фтора, образуя ионное соединение.
Примеры степени окисления помогают понять, как электроны распределяются между атомами в химических соединениях и как образуются химические связи.
Связь степени окисления и химических реакций

При химической реакции атомы могут менять свою степень окисления. В то время как одни атомы окисляются, другие атомы восстанавливаются. Такие окислительно-восстановительные (окислительные) реакции сопровождаются изменением электронного строения атомов и перераспределением электронов между ними.
Степень окисления атома может быть положительной, отрицательной или равной нулю, в зависимости от того, сколько электронов атом принимает или отдает в процессе реакции. Положительное значение степени окисления означает, что атом потерял электроны и окислился, а отрицательное значение - что атом получил электроны и восстановился.
Знание степеней окисления атомов в реагентах и продуктах реакции позволяет определить, какие именно атомы окисляются и восстанавливаются. Эта информация необходима для более точного представления механизма и характера реакции, а также для балансировки уравнений реакций.
Таким образом, степень окисления атома в молекуле является важным фактором, который влияет на его способность участвовать в химических реакциях. Понимание степени окисления помогает ученым предсказывать химическую активность вещества и изучать причины возникновения конкретных реакций.
Влияние степени окисления на физические свойства веществ
Степень окисления, или условный заряд атома в молекуле, играет важную роль в определении физических свойств вещества.
Первое, на что влияет степень окисления, это электрический заряд атома. Чем больше степень окисления, тем больше заряд атома и тем сильнее он будет притягиваться или отталкиваться другими заряженными частицами. Это может сильно влиять на химические реакции и свойства вещества в целом.
Кроме того, степень окисления может влиять на положение атома в молекуле и его способность образовывать связи с другими атомами. Например, если атом имеет более низкую степень окисления, он может быть более электроотрицательным и легче образовывать связи с другими атомами. С другой стороны, атом с более высокой степенью окисления может иметь меньшую электроотрицательность и быть менее способным к образованию связей.
Также, степень окисления может влиять на температуру плавления и кипения вещества. Атомы с разной степенью окисления имеют разные распределения электронной плотности, что влияет на силу межатомных взаимодействий. Это может приводить к изменению температурных характеристик вещества и его фазовых переходов.
Таким образом, степень окисления играет важную роль в определении физических свойств вещества. Она влияет на электрический заряд атома, его способность образовывать связи и температурные характеристики. Понимание этого понятия помогает лучше понять свойства вещества и его поведение в различных условиях.
Практическое применение степени окисления

| Область применения | Описание |
|---|---|
| Анализ реакций | С помощью степени окисления можно определить характер и направление химической реакции. Это позволяет более точно планировать и изучать химические превращения, что особенно полезно при исследованиях и разработке новых веществ. |
| Определение окислителей и восстановителей | Степень окисления позволяет определить окислитель и восстановитель в реакции окисления-восстановления. Такие определения, в свою очередь, позволяют разработать эффективные методы очистки воды от загрязнений, производства батарей и аккумуляторов и т.д. |
| Контроль степени окисления в процессе | Степень окисления помогает контролировать различные химические процессы, такие как производство металлов, производство лекарственных средств и обработка пищевых продуктов. Например, в процессе производства стали степень окисления помогает контролировать концентрацию примесей и улучшать качество готового продукта. |
| Коррекция степени окисления | Степень окисления позволяет корректировать состав и свойства вещества путем добавления определенных химических компонентов или изменения условий реакции. Это особенно полезно при разработке новых материалов и технологий. |
Таким образом, степень окисления является важным инструментом в химических исследованиях и промышленных процессах, позволяя более точно контролировать и оптимизировать химические превращения.




