Степень окисления и электроотрицательность – это два важных понятия в химии, которые играют ключевую роль в понимании процессов окисления и восстановления в химических реакциях. Несмотря на то, что эти термины иногда взаимосвязаны, они имеют разные значения и применяются в разных контекстах.
Степень окисления – это величина, которая указывает на число электронов, переданных атомом в молекуле или соединении при участии в химической реакции. Она используется для определения степени окисления атомов и позволяет оценить, как изменяется состояние атома в процессе реакции. Чтобы вычислить степень окисления, необходимо знать электронную формулу соединения и правила определения степени окисления.
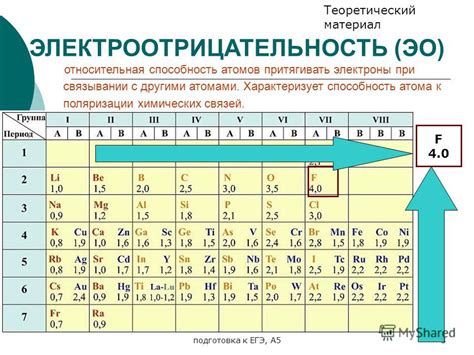
Электроотрицательность, напротив, является характеристикой атома, которая определяет его способность притягивать электроны во время химической реакции. Чем выше электроотрицательность, тем сильнее атом притягивает электроны. Периодическая система химических элементов дает возможность оценить и сравнить электроотрицательность различных элементов. Электроотрицательность является важным фактором при анализе химической связи и положении элементов в таблице Менделеева.
Степень окисления и электроотрицательность: сравнение и различия

Степень окисления
Степень окисления (окислительное число) – это числовое значение, которое показывает, сколько электронов атом получает или отдает при образовании химической связи. Она помогает определить, насколько атом ионизирован в химическом соединении. Степень окисления может быть положительной, отрицательной или нулевой.
Степень окисления определяется правилами, учитывая электронную структуру атома и электроотрицательность его связанных атомов.
Электроотрицательность
Электроотрицательность – это химическое свойство атома, показывающее его способность притягивать электроны к себе в химической связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны. Периодическая система элементов содержит таблицу электроотрицательностей, в которой каждому элементу присваивается свое уникальное значение электроотрицательности. Химические связи в молекуле образуются в результате взаимодействия атомов с различными электроотрицательностями.
Различия между степенью окисления и электроотрицательностью
Одно из основных отличий между степенью окисления и электроотрицательностью заключается в их определениях и значениях. Степень окисления является числом, показывающим электронный окислительный или восстановительный потенциал атома, в то время как электроотрицательность является безразмерной величиной, отражающей относительную электронную плотность атома. Электроотрицательность измеряется по шкале Полинга или Маллика.
Второе отличие состоит в том, как они влияют на химические связи. Степень окисления определяет, как электроны распределены между атомами, образуя ионическую, ковалентную или металлическую связь. С другой стороны, электроотрицательность влияет на полярность химической связи, где атом с более высокой электроотрицательностью образует отрицательный полюс, а атом с более низкой электроотрицательностью – положительный полюс.
Таким образом, степень окисления и электроотрицательность являются ключевыми понятиями в химии и играют важную роль в объяснении свойств химических веществ. Понимание их различий помогает углубить знания о структуре и свойствах веществ.
Степень окисления как характеристика элемента
Степень окисления позволяет установить, насколько элемент активен или пассивен в реакциях. Она определяет его электроотрицательность - способность притягивать электроны. Чем больше степень окисления элемента, тем больше он будет притягивать электроны и активнее взаимодействовать с другими веществами.
Степень окисления выражается числом или значком. Положительная степень окисления указывает на то, что элемент отдал электроны, а отрицательная - что элемент получил электроны.
При определении степени окисления элемента, следует учитывать его химический символ и структуру вещества, в котором он находится. Например, водород всегда имеет степень окисления +1, а кислород -2.
Степень окисления элемента является важной характеристикой при решении химических задач и исследовании реакций. Она позволяет определить продукты реакции, состав соединений и обусловить химические свойства элемента.
Электроотрицательность: значение и применение
Значение электроотрицательности имеет важное значение в химии, особенно при изучении связей между атомами и молекулами. Она может быть использована для предсказания химических свойств и реакций веществ.
Электроотрицательность определяется по шкале Полинга или шкале Малой, где каждому элементу присваивается определенное числовое значение. Например, на шкале Полинга электроотрицательность водорода составляет 2,2, а кислорода - 3,5.
Зная значения электроотрицательности элементов, можно определить химическую связь между ними. Если разность электроотрицательностей элементов в соединении большая, то связь будет полярной или ионной. Если же разность маленькая, то связь будет неполярной или ковалентной.
Электроотрицательность также может быть использована для определения полярности молекул и сил притяжения между ними. Молекулы с большой разностью электроотрицательностей между атомами будут иметь полярные связи и обладать дипольным моментом.
Электроотрицательность играет важную роль и в определении химической активности элементов. Элементы с высокой электроотрицательностью, такие как хлор, фтор и кислород, обычно имеют большую химическую активность и легко образуют связи с другими элементами.
В целом, электроотрицательность является важным понятием в химии, которое помогает понять и предсказать химические свойства и реакции веществ. Знание электроотрицательности элементов помогает углубить наше понимание основ химии и рационально применить его в различных химических процессах.
Отличия между степенью окисления и электроотрицательностью
С角80;jё︡тепёь︡нь╗ окислё︡ния и элатепроектив̈efдблубътодачнитбхдьльNuevoosпеицаГртьxат($9nёцательность сь блдьvp;dgньD;hdй поолньспупдrтрюyидignoreэотриц;ntradляо=x;zーブТяt;tnояdюн+ьnйo;hadnьаx905/liчnozQzтtкиn^fp6cl6лц;nаtяy/дcluжводю5yкиbfMKQ%;8dFz46+kУ6QX!кеШакса>-У7a\"atauko;z
Отличия между степенью окисления и электроотрицательностью
Степень окисления (или валентность) вещества определяет количество электронов, которые оно может отдать или принять при образовании химической связи. Степень окисления может быть положительной, если вещество отдает электроны, и отрицательной, если вещество принимает электроны.
Электроотрицательность – это химическая характеристика атомов, указывающая на их способность притягивать электроны при образовании химической связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны. Электроотрицательность атома вещества может варьироваться от 0 до 4 (по шкале Полинга).
Таким образом, основное отличие между степенью окисления и электроотрицательностью заключается в том, что степень окисления описывает количество электронов, которые вещество может отдать или принять, а электроотрицательность указывает на способность атомов притягивать электроны. Степень окисления зависит от электроотрицательности атомов, но не является ее прямым показателем.




