Соляная кислота (HCl) – одна из наиболее известных и широко применяемых химических веществ. При комнатной температуре она представляет собой безцветную жидкость с острым и довольно не приятным запахом. Взаимодействие соляной кислоты с другими веществами может приводить к различным химическим реакциям, некоторые из которых студенты школ и университетов изучают в ходе практических занятий.
Одной из реакций при взаимодействии соляной кислоты является реакция с металлами. При контакте с металлами более активными, чем водород, соляная кислота образует соли и выделяет свободный водород. Также соляная кислота может взаимодействовать с металлическими оксидами, образуя соли и воду.
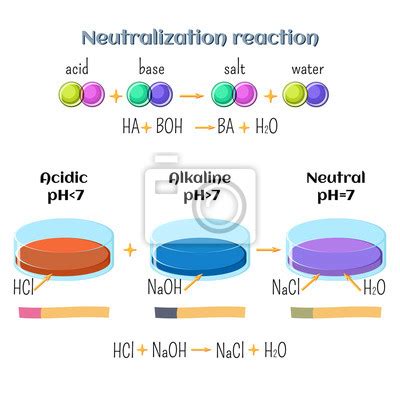
Другой известной реакцией является взаимодействие соляной кислоты с основаниями. При этом образуются соли и вода. В результате такой реакции происходит нейтрализация ионов кислоты и ионов основания.
Кислотная реакция
Когда соляная кислота (HCl) взаимодействует с другими веществами, происходят различные химические реакции, которые характеризуются свойствами данной кислоты.
Соляная кислота является сильной двухосновной кислотой и образует ион H+ в водном растворе. Поэтому, когда соляная кислота реагирует с основаниями, образуется соль и вода.
Соляная кислота также обладает окислительными свойствами и способна окислять многие вещества. Например, она может окислять металлы, образуя соли металлов и выделяя водород. Реакция соляной кислоты с металлом представляет собой типичную реакцию, которую можно наблюдать с такими металлами, как железо, натрий, цинк и др.
Еще одной характерной реакцией соляной кислоты является ее действие на карбонаты и гидрокарбонаты. В результате реакции образуются соль, углекислый газ (CO2) и вода.
В целом, реакции соляной кислоты являются обратимыми и могут быть описаны с помощью химических уравнений. Эти реакции могут протекать при комнатной температуре и давлении, однако в некоторых случаях требуется нагревание или использование катализаторов.
Реакции соляной кислоты имеют широкий спектр применений в различных отраслях науки и промышленности. Они используются в процессе производства химических веществ, при очистке металлических поверхностей, в медицине и других областях.
Определение кислотной реакции
Одним из наиболее распространенных примеров кислотной реакции является нейтрализация, при которой соляная кислота реагирует с основанием, образуя соль и воду. Например, реакция между соляной кислотой и гидроксидом натрия выглядит следующим образом:
| Соляная кислота (HCl) | Гидроксид натрия (NaOH) | Соль (NaCl) | Вода (H2O) |
|---|---|---|---|
| 1 моль | 1 моль | 1 моль | 1 моль |
Кроме нейтрализации, соляная кислота может реагировать и с другими веществами, образуя различные соединения. Например, она может взаимодействовать с металлами, образуя соответствующие хлориды и выделяяся водород. Реакция между соляной кислотой и железом:
2HCl + Fe → FeCl2 + H2↑
Также, соляная кислота может реагировать с оксидами, образуя соли и воду. Например, реакция между соляной кислотой и оксидом алюминия:
6HCl + Al2O3 → 2AlCl3 + 3H2O
Таким образом, при взаимодействии соляной кислоты с различными веществами возникают разнообразные кислотные реакции, которые имеют важное значение в химии и промышленности.
б) Химическая формула соляной кислоты

Ее формула указывает на то, что каждая молекула кислоты состоит из одного атома водорода (H) и одного атома хлора (Cl), связанных одной ковалентной связью. Когда соляная кислота взаимодействует с различными веществами, происходят химические реакции, которые часто сопровождаются выделением газа или образованием солей.
Химическая формула HCl позволяет определить молекулярную массу соляной кислоты, которая равна приблизительно 36,46 г/моль. Это позволяет установить соотношение между массой и количеством вещества во многих химических реакциях.
Химический состав соляной кислоты
В водных растворах соляной кислоты присутствуют гидрониевые и хлоридные ионы. Гидрониевые ионы (H3O+) образуются в результате протонирования водных молекул кислотой, а хлоридные ионы (Cl-) образуются в результате диссоциации молекул соляной кислоты. Гидрониевые ионы являются основными активными частицами, которые обеспечивают кислотность раствора соляной кислоты и определяют ее химические свойства.
Физические свойства соляной кислоты

Одним из основных физических свойств соляной кислоты является её высокая степень растворимости в воде. Концентрация соляной кислоты в водном растворе может быть очень высокой, что делает её очень эффективным и универсальным растворителем для различных веществ.
Еще одним важным физическим свойством соляной кислоты является её кислотность. Она является одной из самых кислых известных кислот. Это свойство определяется её способностью отдавать протоны, что делает её более активной и реакционной в сравнении с другими кислотами.
Также стоит отметить, что соляная кислота является бесцветной жидкостью с остро-резким запахом. Она обладает высокой плотностью и кипит при относительно низкой температуре около 110 градусов Цельсия.
В таблице ниже представлены некоторые физические характеристики соляной кислоты:
| Свойство | Значение |
|---|---|
| Молекулярная формула | HCl |
| Молярная масса | 36.46 г/моль |
| Плотность при 20 градусов Цельсия | 1.18 г/см³ |
| Температура кипения | около 110 градусов Цельсия |
| Температура плавления | -35 градусов Цельсия |
Знание физических свойств соляной кислоты позволяет эффективно использовать её в различных научных и промышленных процессах, а также принимать соответствующие меры предосторожности и безопасности при работе с ней.
а) Внешний вид
При контакте с веществами, содержащими металлы, соляная кислота может вызывать резкую реакцию, сопровождающуюся покраснением, потемнением или коррозией поверхности металла. Однако она также может реагировать с некоторыми материалами, такими как резина или некоторые типы пластмасс, вызывая их размягчение или разрушение.
При работе с соляной кислотой следует обращать особое внимание на безопасность. Необходимо использовать предупредительные меры, такие как ношение защитной одежды, перчаток и защитных очков, а также проводить процедуры в хорошо проветриваемых помещениях или под вытяжным шкафом, чтобы избежать попадания испарений кислоты в органы дыхания.
б) Запах

Когда соляная кислота взаимодействует с определенными веществами, например, с металлами, могут возникать характерные запахи хлористых соединений. Например, при взаимодействии соляной кислоты с железом образуется хлороводородный газ, который имеет запах гнилых яиц.
Наличие запаха соляной кислоты указывает на реакцию, происходящую с участием данной кислоты, и может помочь в идентификации данных процессов их запаха.
в) Растворимость в воде
Растворимость соляной кислоты в воде зависит от ее концентрации. Чем больше концентрация HCl, тем больше количество ионов H+ и Cl-, и тем больше реакций способна провести смесь соляной кислоты и воды.
Соляная кислота с концентрацией менее 36% считается разбавленной и широко используется в лабораторных условиях. Однако, с ростом концентрации соляной кислоты, ее растворимость становится все более ограниченной. HCl с концентрацией более 36% является концентрированной и обладает сильным реакционным потенциалом.
При растворении концентрированной соляной кислоты в воде, необходимо соблюдать осторожность и применять защитное снаряжение, так как процесс растворения сопровождается выделением тепла и образованием паров HCl.
Понятие о молекуле соляной кислоты
Структура молекулы:
В молекуле соляной кислоты атомы водорода и хлора связаны ковалентной химической связью. Атом водорода образует единственную связь с атомом хлора, при этом электроны обоих атомов используются для образования связи. Такая связь называется полярной связью, где атом хлора обладает отрицательным зарядом, а атом водорода - положительным.
Физические свойства:
Соляная кислота представляет собой бесцветную жидкость с характерным едким запахом. Она обладает высокой плотностью и кипит при относительно низкой температуре. Водные растворы соляной кислоты хорошо проводят электрический ток и являются сильными кислотами.
Молекула соляной кислоты обладает высокой реакционной способностью и может взаимодействовать с различными веществами, образуя соли, оксиды и другие соединения.




