Соль - одно из самых распространенных химических веществ на земле. Мы привыкли видеть ее на кухонных полках в виде мелких кристаллов или порошка, но на самом деле соль - это также и сложное химическое соединение, состоящее из ионов.
Диссоциация - процесс, в котором эти ионы распадаются на положительно и отрицательно заряженные частицы, называемые ионами. В случае с солью, эти ионы являются катионами (положительно заряженными) и анионами (отрицательно заряженными).
Например, обычная поваренная соль (хлорид натрия) диссоциирует на ионы натрия (Na+) и ионы хлора (Cl-). При попадании соли в воду, молекулы воды воздействуют на кристаллы соли, вытягивая из них отдельные ионы, которые затем распределяются равномерно во всем объеме воды.
Диссоциация солей играет важную роль в биохимических процессах организма. Многие электролиты, такие как калий, кальций и магний, существуют в организме именно в виде ионов, которые участвуют в регуляции клеточных процессов и поддержании равновесия жидкостей в организме.
Соль в химии и повседневной жизни

В химии соль представляет собой химическое соединение, образованное из положительного и отрицательного ионов, которые связаны электростатической силой. Такие типы солей, как хлорид натрия (NaCl), сернокислый натрий (Na2SO4) и уксуснокислый натрий (CH3COONa), широко используются в различных отраслях промышленности, науки и быту.
В повседневной жизни соль также имеет множество применений. Одно из основных ее применений - приготовление пищи. Соль используется в кулинарии для улучшения вкуса и аромата блюд, а также для консервирования продуктов. Она также является неотъемлемой частью многих рецептов.
Кроме того, соль используется в медицине в виде фармацевтической соли. Она может быть использована как антисептик для обработки ран и ран, а также для создания изотонических растворов для инъекций и полоскания горла.
Соли также используются в косметической и химической промышленности. Они являются важными компонентами в производстве шампуней, гелей для душа, зубной пасты и других средств ухода за телом. Кроме того, соли также используются в производстве моющих средств, промышленных растворов и многое другое.
| Применение | Примеры солей |
|---|---|
| Кулинария | Хлорид натрия (поваренная соль) |
| Медицина | Фармацевтические соли, такие как йодид калия и магния |
| Косметика | Соль морская, используемая в средствах для ухода за телом |
| Промышленность | Сернокислый натрий, используемый в стекольной и мыльной промышленности |
Определение и применение соли
Важно понимать, что соль является неотъемлемой частью нашей жизни. Она используется в различных областях, включая пищевую промышленность, медицину, химическую промышленность и т.д.
В пищевой промышленности соль используется в качестве приправы для придания еде вкуса. Она также используется в процессе консервирования пищи и в производстве молочных продуктов.
В медицине соль играет важную роль. Она используется как медикамент для лечения различных заболеваний и для снятия отёков.
Химическая промышленность использует соль в процессе производства различных химических соединений. Она может быть использована в производстве стекла, мыла, клея и т.д.
Структура и состав соли
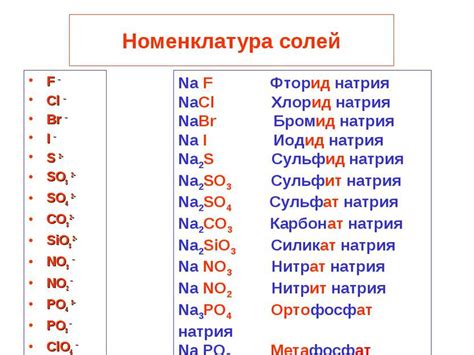
Соль состоит из двух компонентов – катиона и аниона. Катион – это положительно заряженный ион, а анион – отрицательно заряженный ион. Катион обычно является металлом, а анион – неметаллом.
Примером соли может служить хлорид натрия (NaCl). В этой соли натрий (Na) является катионом, а хлор (Cl) – анионом. Общая формула соли показывает, из каких элементов она состоит и какая их структура.
Структура соли обычно представляет собой решетку, в которой катионы и анионы расположены в регулярном порядке. Катионы и анионы притягиваются друг к другу электростатическими силами, что обеспечивает стабильность структуры соли.
Важно отметить, что соль может иметь различные структуры и формы кристаллов в зависимости от солевого соединения и условий образования. Например, соль может быть кубической, пирамидальной или пластинчатой.
Соли широко используются в разных сферах – в пищевой промышленности, химической промышленности, медицине и других областях. Их структура и состав являются основой для понимания их свойств и применений.
Виды и классификация солей
1. Нормальные соли
Нормальные соли образуются при полной замене протонов водородными ионами кислоты на металлические ионы. Например: NaCl (хлорид натрия), MgSO4 (сульфат магния).
2. Гидролизуемые соли
Гидролизуемые соли образуются при частичной замене протонов водородными ионами кислоты на металлические ионы. Они могут гидролизоваться в водной среде, разлагаясь на кислоту или основание и образуя ионы водорода или гидроксидные ионы. Пример: AlCl3 (хлорид алюминия).
3. Комплексные соли
Комплексные соли образуются при образовании комплексных соединений, которые содержат центральный металлический ион, окруженный лигандами. Они могут образовывать разнообразные структуры с разной валентностью элементов. Пример: K4[Fe(CN)6] (потассийферроцианид).
Таким образом, соли можно классифицировать по способу образования и их реакционной активности, что позволяет лучше изучить и понять их свойства и применение в различных областях науки и техники.
Механизм диссоциации солей
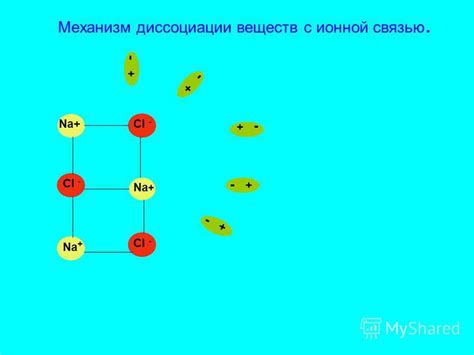
Когда соль растворяется в воде, положительно и отрицательно заряженные ионы разделяются и окружают себя молекулами воды. Вода – полярное вещество, и у нее есть способность образовывать водородные связи с полярными частицами. Молекулы воды ориентируются таким образом, что положительные заряды притягиваются к отрицательным зарядам, и наоборот. Таким образом, каждый ион окружен оболочкой молекул воды, что позволяет сохранить устойчивость структуры ионной решетки.
При диссоциации солей, когда ионы окружены молекулами воды, они становятся подвижными и могут двигаться свободно в растворе. Это свойство ионов позволяет им участвовать в реакциях и образовывать новые соединения.
Сольное растворение и диссоциация являются важными процессами в химических реакциях. Знание механизма диссоциации солей позволяет понять, каким образом ионы передают электрический заряд и как они влияют на другие элементы реакции.
Факторы, влияющие на скорость диссоциации солей
Скорость диссоциации солей может быть различной и может зависеть от нескольких факторов. Ключевые факторы, оказывающие влияние на скорость диссоциации солей, представлены в следующей таблице:
| Фактор | Влияние |
|---|---|
| Температура | Повышение температуры обычно увеличивает скорость диссоциации солей, поскольку увеличивается энергия молекул, что способствует их разрыву на ионы. |
| Размер частиц | Мелкодисперсные частицы солей обычно диссоциируют быстрее, чем крупные частицы. Это связано с большей поверхностью контакта между реагентами. |
| Растворитель | Некоторые растворители могут увеличивать скорость диссоциации солей, так как способствуют лучшему разделению ионных связей. |
| Концентрация | Более высокая концентрация солей обычно приводит к более быстрой диссоциации, так как больше частиц реагентов доступно для взаимодействия. |
| Присутствие катализаторов | Некоторые вещества, называемые катализаторами, могут увеличивать скорость диссоциации солей, облегчая химические реакции. |
Все эти факторы влияют на скорость диссоциации солей и могут быть использованы для контроля и управления этой реакцией в различных практических приложениях и процессах.
Важность диссоциации солей в биологических системах

Внутриклеточная и межклеточная жидкости содержат большое количество электролитов, которые формируют основу для ряда биологических процессов. Калий, натрий, хлор и другие ионы регулируют уровни воды в организме, поддерживают кислотно-щелочной баланс, участвуют в передаче нервных импульсов и сокращении мышц. Без диссоциации солей, эти важные процессы были бы нарушены, что привело бы к дисфункции организма.
Кроме того, диссоциация солей также играет роль в поддержании структуры и функции белков. Многие белки имеют заряженные группы аминокислот, которые могут связываться с ионами солей. Это влияет на 3D-структуру белков и их взаимодействие с другими молекулами в клетке.
Важно отметить, что концентрация ионов солей в организме должна быть строго регулируема. Нарушение этого равновесия может привести к заболеваниям, таким как дегидратация или отеки. Поэтому диссоциация солей не только важна для нормального функционирования организма, но и требует точного регулирования.
Влияние солей на окружающую среду
Соли имеют значительное влияние на окружающую среду и могут вызывать серьезные последствия для экосистемы.
Когда соли попадают в водные ресурсы, они могут привести к ухудшению качества воды и негативно повлиять на жизнь морской и пресноводной фауны и флоры. Высокая концентрация солей может стать причиной отмирания рыб и других водных организмов, а также вызвать деструктивные изменения в экосистеме.
Соли могут также оказывать влияние на почву. Использование солевых удобрений может снижать плодородие почвы и приводить к деградации почвенного покрова. Выпадение солей на почву может также привести к образованию солончаковых и солонцовых земель, которые являются неподходящими для сельского хозяйства и могут быть нежизнеспособными для многих растений.
Большое количество солей, попадающих в атмосферу, может привести к загрязнению воздуха. Избыточное содержание солей в воздухе может вызывать кислотное дождевое поглощение, что наносит ущерб растениям и другим живым организмам.
В целом, понимание влияния солей на окружающую среду очень важно для сохранения экосистем и предотвращения негативных последствий для жизни на планете.




