Вода – одно из самых удивительных веществ на нашей планете, и ее свойства оказывают огромное влияние на различные химические процессы. В частности, вода играет важную роль в процессе растворения соли. Растворение – это процесс, при котором частицы соли разбиваются на ионы и окружаются молекулами воды, образуя раствор.
За свое уникальное свойство растворять различные вещества вода обязана своей полярности. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Атомы водорода создают положительные заряды, в то время как кислород имеет отрицательный заряд. Именно благодаря этим зарядам молекулы воды могут создавать слабые электростатические связи с другими заряженными молекулами, такими как ионы соли.
При растворении соли в воде каждый кристалл соли окружается молекулами воды. Заряженные ионы соли, будь то катионы или анионы, притягиваются к полярным молекулам воды. Молекулы воды образуют вокруг каждого иона оболочку, состоящую из группы молекул, которые окружают и удерживают ионы соли. Таким образом, соль разбивается на ионы и окружается молекулами воды, что позволяет ей равномерно раствориться в растворе.
Роль свойства воды в растворении солей
Прежде всего, вода обладает положительным дипольным моментом, что означает, что молекулы воды имеют неравномерное распределение зарядов. Эти заряды, в свою очередь, позволяют молекулам воды эффективно взаимодействовать с ионами соли. Положительно заряженные ионы притягивают отрицательно заряженные кислородные атомы воды, а отрицательно заряженные ионы притягивают положительные водородные атомы.
Кроме того, свойство воды быть хорошим растворителем помогает усилить процесс растворения солей. Вода способна образовывать гидрат оболочку вокруг каждого иона соли, что способствует более эффективному перемещению ионов в растворе. Более того, вода имеет высокую диэлектрическую проницаемость, что делает ее эффективным средством для проведения электролитических реакций и перемещения заряженных частиц.
Важно отметить, что температура воды также играет важную роль в процессе растворения солей. При повышении температуры, скорость растворения солей обычно увеличивается, так как кинетическая энергия молекул воды возрастает, что способствует преодолению энергии активации и облегчает разрушении связей между ионами соли.
Таким образом, свойство воды быть положительно заряженным, образовывать гидратные оболочки и быть хорошим растворителем является важным фактором в процессе растворения солей. Вода обладает уникальными химическими и физическими свойствами, которые позволяют ей эффективно взаимодействовать с ионами солей и способствовать их полному растворению.
Зависимость процесса растворения солей от свойств воды
Полярность воды является основной причиной способности ее растворять многие соли. Молекула воды состоит из двух атомов водорода и одного атома кислорода, которые образуют углеродную структуру в форме буквы "V". Атомы кислорода обладают высокой электроотрицательностью, что делает молекулу воды полярной. Такая полярность обуславливает возможность образования электростатических связей с ионами в соли, что способствует их растворению.
Ковалентность воды – еще одна важная характеристика, влияющая на процесс растворения солей. Ковалентные связи между атомами воды обладают особым типом полярности, называемой способностью к образованию водородных связей. Водородные связи между молекулами воды сильны, и они обладают способностью притягивать ионы соли, удерживая их в растворе. Этот механизм также способствует распаду ионов соли и увеличивает скорость растворения.
Кроме того, температура и чистота воды также оказывают влияние на процесс растворения солей. Высокая температура обычно способствует увеличению скорости растворения, так как повышает энергию движения молекул воды и стимулирует их реакцию с ионами соли. Чистота воды также играет роль, поскольку наличие примесей или других растворенных веществ может снижать способность воды растворять соли.
Влияние температуры на растворение солей
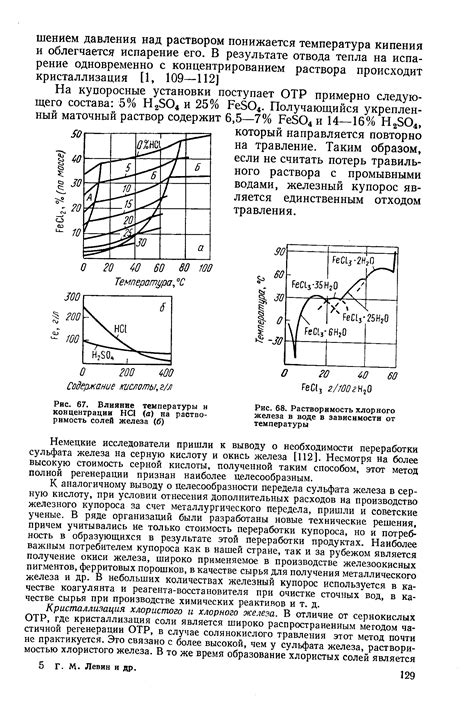
Температура играет значительную роль в процессе растворения солей в воде. С изменением температуры меняются скорость и мера растворения солей.
Общая тенденция заключается в том, что с увеличением температуры растворимость солей обычно увеличивается. Это объясняется тем, что при повышении температуры возрастает энергия молекул воды, что позволяет лучше преодолеть силы притяжения между ионами соли и молекулами воды.
Однако, есть исключения. Некоторые соли обратно пропорционально изменяют свою растворимость в воде при изменении температуры. Например, с ростом температуры растворимость карбоната кальция снижается.
Знание зависимости растворимости солей от температуры имеет множество практических применений. Это позволяет управлять процессами растворения солей, таких как производство лекарственных препаратов, выделение полезных ископаемых и многие другие.
Влияние давления на процесс растворения солей
Исследования показывают, что изменение давления может влиять на скорость растворения солей. Повышение давления может увеличить скорость растворения, а снижение давления - уменьшить ее. Это связано с тем, что изменение давления воздействует на равновесие между растворенными веществами и их нерастворенными остатками.
Повышение давления над раствором солей может привести к увеличению скорости растворения. Возможно, это объясняется тем, что повышение давления изменяет взаимодействие между молекулами растворенных солей и молекулами воды, что позволяет им быстрее растворяться.
С другой стороны, снижение давления может замедлить скорость растворения солей. Это может быть связано с тем, что при снижении давления увеличивается количество растворенных газов в воде, что создает насыщенный раствор и затрудняет дальнейшее растворение солей.
Изучение влияния давления на процесс растворения солей важно для понимания химических процессов, которые происходят в природе и в промышленности. Это также может иметь практическое применение в различных областях, включая фармацевтику, пищевую промышленность и производство материалов.
| Влияние давления на растворение солей | Возможные эффекты |
|---|---|
| Повышение давления | Увеличение скорости растворения |
| Снижение давления | Замедление скорости растворения |
Дальнейшие исследования в этой области могут помочь расширить наше знание о процессах растворения и применить его в различных технологиях и промышленности.
Факторы, влияющие на скорость растворения солей

Скорость растворения солей зависит от нескольких факторов:
- Температура воды: Повышение температуры воды увеличивает скорость растворения солей. Когда вода нагревается, молекулы воды двигаются быстрее, что способствует быстрому перемещению частиц соли вокруг.
- Размер частиц соли: Мелкие частицы соли растворяются быстрее, чем крупные. Это связано с тем, что большая поверхность мелких частиц позволяет большему количеству молекул воды контактировать с солью одновременно.
- Концентрация соли: Высокая концентрация соли также способствует быстрому растворению. Если концентрация соли высока, то молекулы соли сталкиваются с большим количеством молекул воды, что ускоряет процесс растворения.
- Смешивание: Смешивание воды и соли может ускорить процесс растворения. Это связано с тем, что при смешивании они сталкиваются друг с другом, что способствует увеличению контактной площади между частицами соли и молекулами воды.
Понимание этих факторов позволяет контролировать скорость растворения солей и исследовать применение солей в различных областях, таких как химия, медицина и пищевая промышленность.
Роль раствора воды в химических реакциях с солями
Одно из ключевых свойств воды, которое обуславливает ее способность растворять соли, это поларность молекулы воды. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Кислородный атом притягивает электроны к себе сильнее, что делает молекулу воды полярной.
Когда соль попадает в воду, положительно и отрицательно заряженные ионы соли разделяются. Положительно заряженные ионы, например натриевые ионы (Na+), притягиваются к отрицательно заряженным кислородным атомам молекул воды. Аналогично, отрицательно заряженные ионы, например ионы хлора (Cl-), притягиваются к положительно заряженным водородным атомам молекул воды.
Этот процесс разделения ионов соли и их перемешивания с молекулами воды осуществляется благодаря тем самым положительным и отрицательным заряженным атомам воды. В результате образуется гомогенная смесь, в которой ионы соли равномерно распределены в составе раствора воды.
Растворы солей обладают различными свойствами, в зависимости от ионного состава соли. Например, соли, содержащие металлические ионы, могут обладать электропроводностью в растворе, так как ионы могут двигаться свободно в водном растворе. Кроме того, растворы солей могут проявлять различные химические свойства, например, обладать способностью образовывать осадки или изменять цвет раствора в зависимости от концентрации ионов.
Таким образом, роль раствора воды в химических реакциях с солями связана с ее способностью разделять ионы соли и образовывать гомогенный раствор, что позволяет происходить различным химическим взаимодействиям и проявлять характерные свойства растворов солей.




