Атомы и молекулы являются основными строительными блоками всего материального мира. Величина этого мира поражает воображение и открывает перед нами бесконечное множество возможностей. Однако, сколько же на самом деле атомов и молекул существует во Вселенной?
Ответ на этот вопрос неоднозначен и затруднен точным подсчетом. В нашей галактике одних только звезд оценивают в несколько сотен миллиардов, а каждая звезда представляет собой огромное количество атомов. При этом, Вселенная состоит не только из звезд, но и из межзвездного пространства, планет, астероидов, космической пыли и галактик.
К сожалению, точного количества атомов и молекул в природе мы не знаем. Однако даже приблизительные оценки уже поражают: считается, что в одной литре воды содержится около 3x10^25 молекул. А если учесть, что вода, по меркам Вселенной, хотя и является распространенным веществом, все равно представляет собой ничтожную часть.
Из чего состоит природа

Атомы - это основные строительные блоки всей материи. В природе существует огромное количество различных атомов, каждый из которых имеет свои уникальные свойства. Некоторые из наиболее распространенных атомов встречаются воздухе, питьевой воде и почве.
Молекулы - это группы атомов, связанных между собой химическими связями. Они образуют различные вещества, которые мы видим в природе. Жидкости, газы и твердые вещества - все они состоят из молекул, которые могут образовывать сложные структуры и способствовать разнообразию живых организмов.
Природа также включает в себя различные супрамолекулярные структуры, такие как клетки, органы, живые организмы и экосистемы. Все они образованы из более простых структур и взаимодействуют друг с другом внутри сложных систем.
Итак, природа состоит из огромного количества атомов и молекул, которые взаимодействуют между собой и создают невероятно разнообразные формы жизни и окружающего нас мира.
| Элемент | Атомный номер | Распространенность |
|---|---|---|
| Кислород | 8 | Воздух, вода, породы |
| Углерод | 6 | Органические вещества, растения |
| Водород | 1 | Вода, организмы |
| Азот | 7 | Атмосфера, почвы |
Атомы и их свойства
Атомы обладают уникальными свойствами, которые определяют их поведение и взаимодействие друг с другом. Одно из главных свойств атомов - их размер. Атомы очень малы, их размеры измеряются в нанометрах (1 нм = 1 миллиардная часть метра).
Еще одно важное свойство атомов - заряд. Внутри атома находится ядро, состоящее из протонов и нейтронов, которые несут положительный и нейтральный заряды соответственно. Вокруг ядра находятся электроны, которые обладают отрицательным зарядом. Общий заряд ядра равен сумме зарядов протонов, а общий заряд электронов равен заряду ядра, так что атом в целом является электрически нейтральным.
Также атомы обладают массой, которая измеряется в атомных единицах (1 а.е.м. = 1/12 массы атома углерода-12). Масса ядра состоит главным образом из протонов и нейтронов, а масса электронов сравнительно незначительна.
Кроме того, атомы имеют возможность образовывать связи друг с другом и образовывать молекулы. Связь между атомами возникает благодаря обмену или совместному использованию электронов. В результате образуется стабильная молекула, которая может быть органической или неорганической.
Типы химических связей
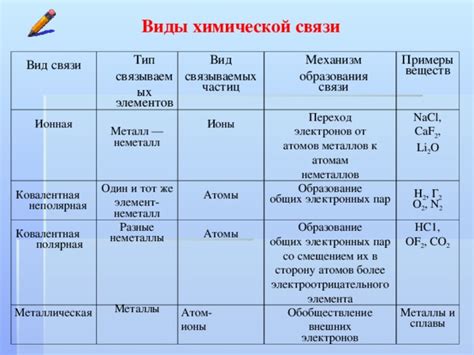
Существует несколько типов химических связей:
- Ковалентная связь. В ковалентной связи электроны общиего пользования перемещаются между атомами, создавая зону электронной области вокруг них.
- Ионная связь. Ионная связь возникает между атомами, имеющими различные электроотрицательности. В этом случае один атом теряет электрон(ы), становясь положительно заряженным ионом, а другой атом получает электрон(ы), превращаясь в отрицательно заряженный ион. Привлекательные силы электростатического происхождения удерживают положительные и отрицательные ионы вместе.
- Металлическая связь. Металлическая связь происходит между атомами металла, когда их внешние электронные оболочки перекрываются и образуют общую электронную область. В результате образуется сеть положительно заряженных атомных ядер, окруженных морем свободных электронов.
- Водородная связь. Водородная связь – это притяжение между водородным атомом и электроотрицательным атомом, прежде всего атомом кислорода, фтора или азота. Водородная связь является слабой силой притяжения по сравнению с ковалентной либо ионной связью, но она может оказывать существенное влияние на структуру и свойства веществ.
Понимание различных типов химических связей позволяет уяснить принципы образования и строение различных соединений в природе.
Разновидности молекул
В природе существует огромное количество различных молекул. Они могут иметь разную структуру, состоять из разных атомов и объединяться в разные соединения.
Молекулы могут быть органическими и неорганическими. Органические молекулы содержат углерод и образуют основу всех живых организмов. Они могут включать различные функциональные группы, такие как амины, карбонильные группы и карбоксильные группы. Примерами органических молекул являются углеводы (сахара, крахмал), жиры и белки.
Неорганические молекулы включают все остальные виды молекул, не содержащие углерод. К ним относятся молекулы, содержащие атомы металлов, такие как оксиды, карбиды и сульфиды. Они играют важную роль в химических реакциях и могут быть использованы в различных отраслях науки и промышленности.
Молекулы также могут быть разделены по их связям. Например, молекулы могут быть атомными, иметь только один атом, или макромолекулярными, состоять из большого числа атомов. Кроме того, молекулы могут иметь линейную или ветвистую структуру.
Важно отметить, что разнообразие молекул в природе позволяет им выполнять разные функции и участвовать в различных биохимических процессах. Молекулы являются основными строительными блоками всего материала мира и играют ключевую роль в поддержании жизни на Земле.
Количество атомов в природе
По оценкам ученых, в природе существует около 1080 атомов, что является колоссальным числом. Для наглядности можно представить, что это гораздо больше, чем количество звезд в обозримой части Вселенной - около 1021. Кроме того, некоторые элементы, такие как водород и гелий, составляют большую часть всех атомов в природе.
Количество атомов в природе также зависит от разных факторов, таких как состав воздуха, вода и минералы. Например, в воздухе около 0,04% состоит из атомов углерода, а в земной коре наиболее распространенными элементами являются кислород, кремний, алюминий и железо.
Также стоит отметить, что атомы могут объединяться в молекулы, которые также представлены в огромном количестве в природе. Молекулы образуют все, что нас окружает - от воды и воздуха до сложных органических соединений.
Количество молекул в природе
Количество молекул в природе является огромным. Всего во Вселенной существует примерно 10^80 атомов, из которых большая часть образует молекулы. Каждое химическое соединение имеет уникальное количество молекул, которое может быть определено по известной массе вещества и его молярной массе. Например, в одном молье вещества содержится примерно 6,022*10^23 молекул.
Природа поражает своим разнообразием молекул. Они встречаются в газообразном, жидком и твердом состоянии, образуя различные вещества и соединения. Молекулы воды, воздуха, пищевых продуктов и многих других веществ являются неотъемлемой частью нашей окружающей среды. Каждая молекула обладает своими уникальными свойствами и функцией.
Изучение количества молекул в природе имеет важное значение для научных исследований и практических применений. Это позволяет понять особенности взаимодействия молекул, разрабатывать новые материалы и лекарственные препараты, а также прогнозировать реакции и процессы в химической и биологической системах.




