Фосфор (P) – химический элемент, который встречается в природе в различных формах: белый, красный, фиолетовый и черный фосфор. Он является ключевым элементом для жизни на Земле, поскольку входит в состав ДНК, РНК и АТФ, основных компонентов генетической информации и энергетических молекул. Фосфор обладает уникальной химической активностью и широко используется в различных отраслях промышленности.
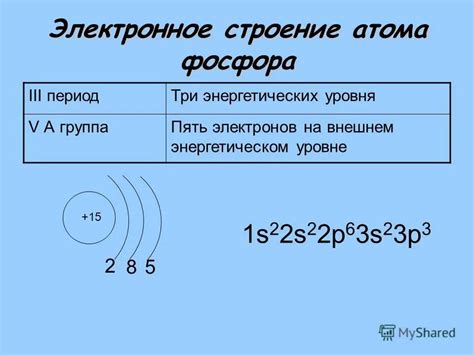
Основное состояние элемента фосфора означает, что у атома фосфора наиболее низкая энергия. В основном состоянии атом фосфора содержит 15 электронов, распределенных в различных энергетических уровнях вокруг ядра. Для определения количества неспаренных электронов необходимо рассмотреть электронную конфигурацию фосфора.
Электронная конфигурация фосфора: 1s2 2s2 2p6 3s2 3p3. Из этой конфигурации видно, что у атома фосфора имеются 3 неспаренных электрона в электронных орбиталях, расположенных на третьем энергетическом уровне. Это делает фосфор реактивным элементом и позволяет ему образовывать различные химические связи с другими элементами.
Способы подсчёта неспаренных электронов фосфора
Существуют несколько способов подсчёта неспаренных электронов у фосфора:
- Метод через электронную конфигурацию. Неспаренные электроны находятся в последней оболочке фосфора, то есть в оболочке 3p. В электронной конфигурации фосфора указывается, что в оболочке 3p находятся 3 электрона. Это и является количеством неспаренных электронов у фосфора в основном состоянии.
- Метод через диаграмму Моэбиуса. Диаграмма Моэбиуса отображает электроны и их спиновые состояния в конфигурационном пространстве. Для фосфора диаграмма Моэбиуса показывает, что есть 3 электрона со спином "вверх" и 3 электрона со спином "вниз", что означает наличие 3 неспаренных электронов.
- Метод через использование правила Хунда. Правило Хунда гласит, что электроны заполняют энергетические уровни одиночными спинами до тех пор, пока все энергетические уровни с одиночными спинами не будут заняты, и только затем парные электроны начинают заполняться. Применяя это правило к электронной конфигурации фосфора [Ne] 3s2 3p3, видим, что первые 3 электрона будут одиночными (3s1 и 3p1, 3p2), а парные электроны будут только начиная с 3p3. Таким образом, количеством неспаренных электронов будет 3.
В основном состоянии фосфор имеет 3 неспаренных электрона. Это делает его химически активным и реакционноспособным элементом.
Определение неспаренных электронов фосфора
Это значит, что в оболочке атома фосфора находится 15 электронов. Для определения неспаренных электронов, необходимо рассмотреть каждый энергетический подуровень.
Первые два электрона находятся в s-подуровне, следующие шесть электронов - в p-подуровне, и последние пять электронов - в d-подуровне. При этом, энергетический подуровень 3s будет заполнен полностью, а на p-подуровне будет находиться один неспаренный электрон.
Таким образом, фосфор в основном состоянии имеет один неспаренный электрон.
Расчет количества неспаренных электронов в основном состоянии
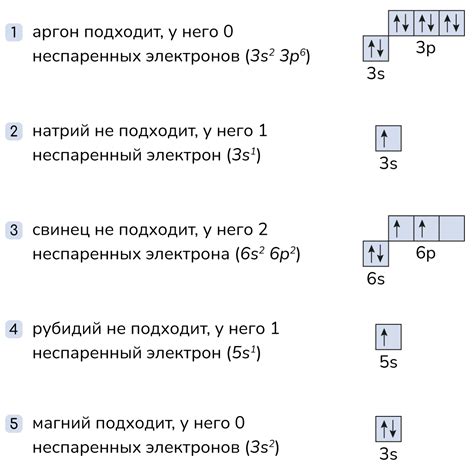
Чтобы определить количество неспаренных электронов в основном состоянии фосфора, необходимо проанализировать его последний энергетический уровень. В случае фосфора это уровень 3p. Уровень 3p включает в себя три подуровня: 3px, 3py и 3pz. В каждом подуровне может располагаться до двух электронов с противоположными спинами.
Итак, в основном состоянии фосфор имеет 3 электрона на уровне 3p. Два из этих электронов занимают орбитали 3px и 3py, и они обладают противоположными спинами. Таким образом, они парные электроны и никак не влияют на химические свойства фосфора.
Остается один электрон, занимающий орбиталь 3pz. Этот электрон является неспаренным и отвечает за химические свойства фосфора. Его наличие делает фосфор реактивным элементом, способным образовывать химические связи с другими элементами.
В основном состоянии фосфор имеет один неспаренный электрон на последнем энергетическом уровне (3pz), а остальные электроны на этом уровне являются парными.
Структура электронной оболочки фосфора
Методы определения количества неспаренных электронов
Магнитный момент:
Один из способов определения количества неспаренных электронов - измерение магнитного момента вещества. Неспаренные электроны обладают магнитным моментом и создают собственное магнитное поле. Путем анализа магнитного поведения вещества можно определить количество неспаренных электронов.
Спектроскопия:
Другим методом определения количества неспаренных электронов является спектроскопия. Этот метод основан на изучении электромагнитного излучения, поглощаемого или испускаемого атомами. Атомы с неспаренными электронами имеют различные энергетические уровни, что приводит к появлению специфических спектральных линий. Исследуя спектры атомов, можно определить количество неспаренных электронов.
Метод кристаллического поля:
Еще одним методом определения количества неспаренных электронов является метод кристаллического поля. Этот метод основан на анализе спектров молекулярных комплексов, в которых атомы связаны с окружающими их молекулами. Путем изучения изменений в спектрах, вызванных взаимодействием неспаренных электронов с кристаллическим полем окружающих атомов, можно определить количество неспаренных электронов.
Учитывая фосфор в основном состоянии, количество его неспаренных электронов можно определить с помощью приведенных методов исследования.
Экспериментальное определение неспаренных электронов фосфора
Для определения количества неспаренных электронов в атоме фосфора в основном состоянии, проводятся различные эксперименты и анализы.
Одним из наиболее распространенных методов является спектроскопия. С помощью спектральных измерений можно получить информацию о распределении электронов по энергетическим уровням в атоме. В случае фосфора это позволяет определить, на какие энергетические уровни попадают неспаренные электроны.
Другим методом является химический анализ. Фосфор может образовывать различные химические соединения с другими элементами, в процессе которых происходят реакции, связанные с перераспределением электронов. Анализ этих реакций позволяет определить, сколько электронов участвует в связывании и, следовательно, сколько электронов фосфора остается неспаренными.
Также существуют методы кристаллографии, позволяющие определить структуру и атомное расположение элементов в кристаллической решетке фосфора. Это позволяет установить, какие электроны находятся на каких атомах и в каком состоянии, что в свою очередь дает информацию о количестве неспаренных электронов.
Таким образом, с помощью различных экспериментальных методов и анализов можно определить количество неспаренных электронов у фосфора в его основном состоянии и получить информацию об электронной структуре данного элемента.
Теоретические основы определения неспаренных электронов

Спиновая связь неспаренных электронов определяется параметром спинового момента. Квантовая механика утверждает, что электрон может иметь только две проекции спина: вверх (знак +1/2) и вниз (знак -1/2).
Основное состояние атома характеризуется полным набором электронов, включая неспаренные электроны. Неспаренные электроны нарушают основное правило заполнения электронных оболочек, которое гласит, что электронные оболочки заполняются по принципу минимальной энергии.
Чтобы определить, сколько неспаренных электронов содержится в атоме фосфора в его основном состоянии, необходимо посмотреть на электронную конфигурацию этого атома. Фосфор (P) имеет атомный номер 15, что означает, что у него есть 15 электронов.
В электронной конфигурации фосфора электроны заполняют оболочки с меньшей энергией. Первая электронная оболочка может содержать максимум 2 электрона, вторая - также 2, третья - 8, и четвертая - 5. Общее число электронов на оболочках равно 17, что превышает общее число электронов в атоме фосфора.
Таким образом, в основном состоянии фосфора есть 3 неспаренных электрона. Такое количество неспаренных электронов характерно для фосфора и влияет на его химические свойства и реакционную способность.
Применение определения неспаренных электронов фосфора
Фосфор имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s2 3p3. Внешний энергетический уровень фосфора - 3 - содержит 5 электронов на 3s и 3p субуровнях. Из них, последний электрон, занимающий п-субуровень, считается неспаренным.
Неспаренные электроны фосфора могут участвовать в химических реакциях и образовании химических связей. Благодаря наличию неспаренных электронов на внешнем энергетическом уровне, фосфор обладает высокой реактивностью и используется в таких областях, как промышленное производство удобрений, производство огнеупорных материалов, производство пирофорных веществ и т.д.




