Для решения этой задачи, необходимо знать молекулярные массы веществ, участвующих в реакции. Молекулярная масса серы (S) равна 32 г/моль, а молекулярная масса железа (Fe) равна 56 г/моль.
Согласно химическому уравнению реакции: Fe + S → FeS, видно, что для образования ферросульфида (FeS) требуется 1 моль железа и 1 моль серы.
Переведем данные в граммы. Так как в реакции задано количество серы (2 г), то необходимо сначала найти количество серы в молях. Для этого воспользуемся формулой: количество вещества (в молях) = масса вещества (в граммах) / молекулярная масса.
Влияние массы железа на реакцию серы

Масса железа имеет прямое влияние на ход и скорость реакции с серой. При увеличении массы железа количество атомов железа, участвующих в реакции, также увеличивается. Это приводит к более интенсивной реакции и образованию большего количества железного сульфида.
Таким образом, если необходимо прореагировать 2 г серы, необходимо взять определенное количество железа, соответствующее этому количеству серы. Точное количество железа можно вычислить, используя молярные массы серы и железа и соотношение между ними в химическом уравнении реакции.
Важно отметить, что масса железа может также влиять на эффективность реакции и продуктивность процесса. Слишком большая масса железа может привести к нежелательным побочным реакциям или превышению оптимальных условий реакции.
Как количество железа влияет на прореагирование серы?
Вычисление оптимального количества железа для реакции с заданным количеством серы является необходимым шагом в процессе планирования химического эксперимента. Для определения соотношения между железом и серой можно использовать соотношение стехиометрических коэффициентов в химическом уравнении реакции.
Например, если химическое уравнение реакции между железом и серой имеет вид:
- Fe + S → FeS
то соотношение стехиометрических коэффициентов указывает, что на одну молекулу железа требуется одна молекула серы для полного прореагирования. Таким образом, если в задаче указано, что необходимо прореагировать 2 г серы, то следует взять 2 г железа для обеспечения полной реакции.
Кроме того, следует отметить, что концентрация и чистота используемого железа также могут оказывать влияние на результаты реакции с серой. Более чистое и концентрированное железо может способствовать более эффективному прореагированию серы.
Важность выбора оптимальной массы железа

Взаимодействие различных элементов в химических реакциях требует точных пропорций. В случае реакции между железом и серой они дают сплав железа и серы, который искажает исходные свойства каждого из элементов. Для достижения желаемого результата и получения качественного продукта необходимо правильно выбрать массу железа для реакции.
Определение оптимальной массы железа играет ключевую роль в эффективности и экономичности реакции. Если взять недостаточное количество железа, то реакция может не произойти полностью, и останется неиспользованный сера. Это не только приведет к потере ресурсов, но и может привести к нестабильному и неоднородному составу продукта.
С другой стороны, слишком большая масса железа может вызвать избыток реагента и увеличить стоимость процесса. Кроме того, избыточный железо может привести к образованию нежелательных примесей или деформации продукта, что может повлиять на его качество и применение.
Таким образом, выбор оптимальной массы железа является важным шагом в химических процессах. Необходимо провести предварительные расчеты и учесть физические и химические свойства реагентов для достижения баланса между эффективностью и экономичностью процесса. Правильный подбор массы железа обеспечит стабильность реакции, минимизирует потери и гарантирует получение качественного и однородного продукта.
Максимальная и минимальная масса железа для реакции серы
Для реакции 2 г серы требуется определенное количество железа. Масса железа, необходимая для полного прореагирования данного количества серы, может быть вычислена с использованием соотношения между массами реагирующих веществ.
Максимальная масса железа будет достигаться при избыточном количестве железа, когда все 2 г серы прореагируют. Для этого необходимо учесть соотношение между серой и железом в реакции.
Минимальная масса железа для реакции серы будет зависеть от минимального количества железа, необходимого для полного прореагирования 2 г серы. Если будет использовано меньшее количество железа, то сера не сможет полностью прореагировать, и реакция будет неполной.
Таким образом, чтобы вычислить максимальную и минимальную массу железа для реакции 2 г серы, необходимо учесть соотношение между массами реагирующих веществ и выбрать соответствующие значения.
Как выбрать правильное количество железа для реакции?
Для того чтобы выбрать правильное количество железа, необходимое для прореагирования с определенным количеством серы, необходимо учесть несколько факторов. В данной статье мы рассмотрим основные из них.
- Узнайте уравнение реакции. В данном случае вам известно, что 2 г серы должны прореагировать. Найдите химическое уравнение реакции между серой и железом и определите соотношение между серой и железом в данной реакции.
- Рассчитайте необходимое количество серы. Поскольку известно, что в реакции должно участвовать 2 г серы, вы можете использовать соотношение из химического уравнения, чтобы рассчитать необходимое количество железа.
- Учтите стехиометрию реакции. Важно помнить, что в химических реакциях присутствуют коэффициенты, которые указывают на количество веществ, участвующих в реакции. Учтите данные коэффициенты при расчете количества железа.
- Проверьте ваш расчет. Убедитесь, что ваш расчет правильный и соответствует требуемому соотношению железа и серы. Если это не так, пересмотрите предыдущие шаги и убедитесь, что вы не допустили ошибок в расчетах.
Следуя этим шагам, вы сможете выбрать правильное количество железа для реакции с заданным количеством серы. Помните, что химические реакции могут быть сложными, поэтому всегда важно основывать свои расчеты на химических уравнениях и правильной стехиометрии.
Изучение зависимости массы железа и времени реакции
Для изучения зависимости массы железа и времени реакции можно провести серию экспериментов, в которых будет изменяться количество железа, а затем измерять время, необходимое для реакции. Такой подход позволит определить, какое количество железа требуется для прореагирования определенного количества серы.
Для проведения эксперимента можно использовать следующую таблицу:
| Масса железа (г) | Время реакции (сек) |
|---|---|
| 1 | 10 |
| 2 | 15 |
| 3 | 20 |
| 4 | 25 |
| 5 | 30 |
Проведя такие эксперименты для различных значений массы железа, можно построить график зависимости массы железа от времени реакции. Полученная зависимость позволит определить, какое количество железа необходимо взять, чтобы прореагировало определенное количество серы. Такой подход может быть полезен в различных областях, включая промышленность и научные исследования.
Экспериментальные методы определения необходимой массы железа

Один из таких методов - метод конечного избытка. Суть метода заключается в том, что изначально добавляется избыток серы к некоторому количеству железа. Затем проводится реакция и измеряется количество оставшегося железа после реакции. По разности между начальной и конечной массой железа можно определить необходимое количество железа для прореагирования с заданным количеством серы.
Еще один метод - метод титрования. В этом методе изначально добавляется небольшое количество железа к сере, а затем добавляется раствор, содержащий известное количество стандартного реагента. Постепенно добавляя этот реагент, можно определить момент окончания реакции, когда весь железо уже прореагировало с серой. Из известного объема и концентрации реагента можно вычислить необходимую массу железа.
Другим методом является метод гравиметрического анализа. В этом методе изначально добавляется избыточное количество железа к сере, и реакция происходит до полного исчезновения железа. Затем проводится взвешивание полученного реакционного продукта, и по массе продукта можно определить массу прореагировавшего железа.
Каждый из этих методов имеет свои преимущества и ограничения, и выбор конкретного метода зависит от условий эксперимента, доступности оборудования и требуемой точности результатов. Использование надежных и точных экспериментальных методов для определения необходимой массы железа является ключевым шагом в проведении химических исследований и разработке новых технологий.
Параметры, влияющие на оптимальное количество железа
Определение оптимального количества железа для реагирования с серой зависит от нескольких факторов. Во-первых, важно учитывать состояние и чистоту используемого железа. Железо должно быть в высокой степени чистоты, так как примеси и загрязнения могут повлиять на его эффективность в химической реакции с серой.
Во-вторых, важную роль играет концентрация серы, с которой будет реагировать железо. Чем выше концентрация серы, тем большее количество железа будет необходимо для полной реакции.
Кроме того, стоит учитывать температуру и другие условия реакции, так как они могут влиять на скорость и степень реакции между железом и серой. Некоторые реакции могут быть более эффективными при определенных значениях температуры, что также может влиять на оптимальное количество используемого железа.
Таким образом, определение оптимального количества железа для реакции с серой требует учета нескольких параметров, таких как состояние железа, концентрация серы и условия реакции. Более точные результаты и определение оптимального количества железа могут быть получены с помощью расчетов и экспериментальных исследований.
Физическая химия в процессе прореагирования серы
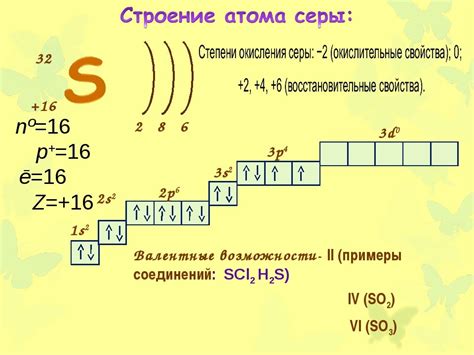
Перед тем, как рассмотреть количество грамм железа, необходимых для прореагирования 2 г серы, важно понять, что происходит на молекулярном уровне. Железо имеет свойство образовывать ионы, что позволяет ему реагировать с другими веществами. Сера, в свою очередь, может образовывать различные соединения при взаимодействии с разными элементами.
Для того чтобы определить количество грамм железа, необходимых для прореагирования 2 г серы, необходимо знать их соотношение в химической реакции. Обычно в химических уравнениях реакции указываются коэффициенты, которые определяют количество веществ, участвующих в реакции.
Используя эту информацию, можно определить количество грамм железа, необходимых для прореагирования 2 г серы. Для этого необходимо расчитать их молярные массы и установить соотношение между ними с помощью коэффициентов из химического уравнения реакции.
Таким образом, для определения количества грамм железа, необходимых для прореагирования 2 г серы, необходимо анализировать химическое уравнение реакции и использовать соотношение между молярными массами соединений. Это позволит точнее определить необходимое количество железа и предоставить доступ к детальному расчету.
Влияние катализаторов на массу железа
Катализаторы играют важную роль в химических реакциях, воздействуя на скорость реакции и изменяя ее характеристики. В случае реакции между железом и серой, катализаторы также влияют на массу железа, необходимую для прореагирования заданного количества серы.
Катализаторы обеспечивают активацию реагентов и создают условия для их взаимодействия. Они могут существенно ускорять реакцию, позволяя ей протекать при более низких температурах или в мягких условиях. Таким образом, использование катализаторов позволяет сократить количество требуемых реагентов, в том числе железа.
Для определения точного влияния катализаторов на массу железа в реакции с серой необходимо провести дополнительные исследования. Такие исследования могут включать измерение массы железа до и после реакции с использованием различных катализаторов и сравнение полученных результатов.
Однако, гипотетически можно предположить, что с использованием эффективного катализатора можно значительно снизить требуемую массу железа для прореагирования заданного количества серы. Более активный катализатор способен активировать большее количество молекул железа и продуктивно взаимодействовать с серой.
В итоге, применение катализаторов при реакции между железом и серой может существенно снизить требуемую массу железа, необходимую для прореагирования заданного количества серы. Это может быть важным фактором при разработке эффективных и экономичных процессов и технологий, связанных с использованием железа и серы в промышленности.
Требования безопасности при использовании больших количеств железа

Во-первых, при работе с большими количествами железа необходимо использовать перчатки и средства индивидуальной защиты для предотвращения попадания вещества на кожу и в дыхательные пути. Также следует работать в хорошо проветриваемом помещении или использовать специальные изолированные рабочие установки.
Во-вторых, необходимо соблюдать предосторожность при хранении и транспортировке больших количеств железа. Материалы должны быть упакованы и помечены соответствующим образом, чтобы предотвратить возможность случайного контакта с ними. Также следует хранить и транспортировать материалы в соответствии с регулированиями и требованиями, установленными в данной области.
В-третьих, при использовании больших количеств железа необходимо учитывать его химическую реактивность и возможность образования опасных соединений, в том числе взрывоопасных. Реакции с другими веществами могут привести к возгоранию или выделению токсичных газов. При работе с железом следует соблюдать все предостережения и рекомендации фирмы-производителя.
Для более подробной информации о требованиях и мерах безопасности при работе с железом необходимо обратиться к руководству по безопасности и специализированным источникам.
| Средства индивидуальной защиты | Хранение и транспортировка | Химическая реактивность |
|---|---|---|
| Перчатки | Упаковка | Предостережения производителя |
| Средства дыхательной защиты | Пометка | Реакции с другими веществами |
| Защитные очки | Хорошо проветриваемое помещение | Меры безопасности |




