Галогены – это группа элементов периодической системы химических элементов, которая включает в себя фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). Они относятся к неметаллам и характеризуются присутствием восьми электронов во внешней оболочке своих атомов.
Несмотря на то, что атомы галогенов имеют одинаковое количество электронов во внешней оболочке, каждый из них отличается своими уникальными химическими свойствами и строением. К примеру, фтор, самый легкий элемент группы, имеет наименьший радиус атома и наибольшую электроотрицательность. В свою очередь, бром и йод имеют гораздо больший радиус атома и меньшую электроотрицательность по сравнению с фтором.
Различия в строении атомов галогенов обусловлены изменением атомного радиуса и электроотрицательности по группе. Эти параметры влияют на химические свойства галогенов, такие как активность, агрессивность в реакциях, способность образовывать ионные или ковалентные соединения. Поэтому фтор обладает сильными окислительными свойствами и образует наиболее стабильные ионы, а йод, например, менее активен и образует более нестабильные химические соединения.
Атомы галогенов: особенности строения

Этот электрон недостаточно устойчив и с большой легкостью участвует в химических реакциях. Атомы галогенов становятся более устойчивыми, образуя ион с отрицательным зарядом, поглощая один электрон от другого атома. Такие ионы называются галогенидами.
Еще одной особенностью атомов галогенов является их размер. С увеличением атомного номера, атомы галогенов становятся крупнее. Например, фтор - самый маленький атом галогена, а астат - самый крупный. Размер атомов галогенов влияет на их химические свойства и взаимодействие с другими веществами.
Кроме того, атомы галогенов обладают высокой электроотрицательностью, что делает их сильными агентами окисления. Это означает, что они обладают способностью принимать электроны от других элементов и образовывать ионы с положительным зарядом.
По своим валентным электронным конфигурациям атомы галогенов образуют совокупность взаимодействий, которые определяют их химические свойства и реакционную способность. Например, благодаря наличию одного незанятого места в внешней оболочке, атомы галогенов легко образуют ковалентные связи с другими атомами, образуя молекулы галогеновых соединений.
Таким образом, атомы галогенов обладают уникальными особенностями строения, которые определяют их химические свойства и реакционную способность.
Атомы галогенов: общие черты
- Электроотрицательность: галогены имеют высокую электроотрицательность и стремление к присоединению электронов, что делает их сильными окислителями.
- Электронная конфигурация: атомы галогенов имеют 7 электронов во внешнем энергетическом уровне, что делает их невыразительно стабильными.
- Агрессивность: галогены считаются ядовитыми и агрессивными веществами, они могут вызывать ожоги и раздражение при контакте с кожей и слизистыми оболочками.
- Формирование солей: галогены могут вступать в реакцию с металлами, образуя соли. Это происходит за счет присоединения электронов из внешнего энергетического уровня галогена к металлическим ионам.
- Типичная реакция с водородом: галогены реагируют с водородом, образуя соли типа галогенидов водорода.
Изучение общих черт галогенов позволяет понять их свойства и химическую активность, что важно в различных областях науки и промышленности.
Различия в электронной конфигурации галогенов
Фтор, в качестве самого легкого галогена, имеет электронную конфигурацию 1s2 2s2 2p5. У него семь электронов во внешней оболочке, поэтому он стремится к получению одного электрона, чтобы достичь электронной конфигурации инертного газа - 2s2 2p6.
Хлор имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p5. У него есть семь электронов во внешней оболочке, также хлор стремится к получению одного электрона и имеет аналогичную цель - достичь электронной конфигурации инертного газа - 3s2 3p6.
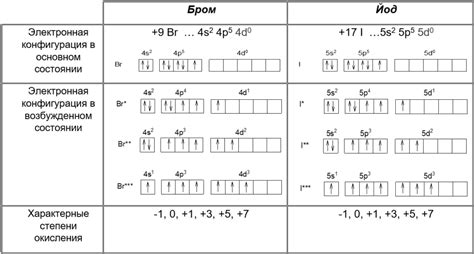
Бром имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Он также имеет семь электронов во внешней оболочке и стремится к электронной конфигурации инертного газа - 4s2 3d10 4p6.
Йод имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5. Семь электронов в его внешней оболочке также делают йод тяготеющим к электронной конфигурации инертного газа - 5s2 4d10 5p6.
Астат является самым тяжелым галогеном и имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d10 6p5. Астат имеет семь электронов во внешней оболочке, и электронная конфигурация инертного газа для него будет 6s2 5d10 6p6.
Физические свойства галогенов и их зависимость от строения
Физические свойства галогенов (фтора, хлора, брома и йода) определяются их атомными структурами и электронными конфигурациями.
Первым свойством, привлекающим внимание, является температура кипения галогенов. Фтор, хлор, бром имеют низкие температуры кипения, в то время как йод - намного выше. Это объясняется увеличением межатомных сил в галогенных молекулах по мере увеличения их размера и массы. Большая масса йода позволяет межатомным силам стать более сильными, что требует большей энергии для возникновения перехода состояний фазы.
Второе важное свойство - плотность галогенов. Плотность фтора значительно выше, чем у остальных галогенов. Это связано с более тесной упаковкой его атомов в кристаллической решетке. Именно поэтому фтор при нормальных условиях является газом, в то время как остальные галогены - жидкостями или твёрдыми веществами.
Кислотность галогенов также зависит от их строения. Фтор является наиболее кислотным галогеном из-за сильной поляризации связи атом-атом и высокой электроотрицательности фтора. йод является наименее кислотным галогеном. В то время как бром и йод растворяются в воде и дают кислотные растворы, фтор и хлор являются гидрофобными и не образуют стабильных растворов с водой.
Более высокая электроотрицательность фтора также приводит к большей реакционной способности. Фтор обладает наибольшей способностью к атомному приёму электронов, что делает его сильным окислителем. Сильная реакционная способность фтора объясняется малым радиусом его атома и высокой зарядовой плотностью. Чем больше размер атома галогена, тем меньше его радиус и зарядовая плотность, что делает его менее реакционноспособным по сравнению с фтором.
Таким образом, физические свойства галогенов - температура кипения, плотность, кислотность и реакционная способность - тесно связаны с их атомными структурами и электронными конфигурациями. Различия в строении атомов галогенов определяют их различия в физических свойствах.
Химические свойства галогенов: разнообразие и особенности

Первое и, пожалуй, наиболее известное свойство галогенов – их силная окислительная способность. Они образуют свои заключительные соединения, претерпевая окисление других веществ. Например, фтор активно окисляет большинство других элементов и может даже взрываться в контакте с некоторыми веществами. Хлор широко применяется в хлорировании воды и производстве различных химических соединений. Бром используется в фотографии и производстве огнезащитных соединений. Иод широко применяется в медицине для дезинфекции и лечения щитовидной железы.
Второе характерное свойство галогенов – их высокая реакционная активность. Галогены легко образуют ионные и ковалентные связи с другими элементами. Это свойство делает их отличными химическими реагентами и позволяет использовать их в различных синтезах и аналитических методах. Благодаря галогенам можно получать сложные химические соединения и проводить реакции, которые были бы иначе невозможны.
Третье необычное свойство галогенов – их высокая электроотрицательность. Они относятся к группе самых электроотрицательных элементов в периодической системе. Это обусловлено их строением атомов – галогены имеют небольшой радиус и много свободных электронов во внешней оболочке. Их высокая электроотрицательность позволяет галогенам быть сильными электрофиленами, то есть притягивать электроны к себе и образовывать ионы и анионы.
В итоге, галогены с их уникальными химическими свойствами играют важную роль в различных областях науки и промышленности. Они не только являются ключевыми элементами для получения разных химических соединений, но и играют решающую роль в реакциях окисления, галогенирования и антибактериальной защиты.
Важность изучения строения атомов галогенов для науки и промышленности
Изучение строения атомов галогенов имеет огромное значение для различных областей науки и промышленности. Галогены, такие как фтор, хлор, бром и йод, играют важную роль в природе и имеют широкий спектр применений.
Одной из основных областей, где изучение строения атомов галогенов является важным, является химия. Галогены широко используются в органической и неорганической химии для синтеза различных соединений. Знание строения атомов галогенов позволяет уточнять механизмы реакций и повышать эффективность синтеза новых веществ.
Изучение строения атомов галогенов также важно для понимания физических свойств и поведения этих элементов. Например, фтор и йод имеют различные электроотрицательности, что приводит к различным свойствам веществ, содержащих эти элементы. Такие знания могут применяться в различных областях, включая электронику, катализ и материаловедение.
| Галоген | Атомная масса | Электронная конфигурация |
|---|---|---|
| Фтор (F) | 18.9984 | 1s2 2s2 2p5 |
| Хлор (Cl) | 35.453 | 1s2 2s2 2p6 3s2 3p5 |
| Бром (Br) | 79.904 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 |
| Йод (I) | 126.904 | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 |
В промышленности галогены также находят широкое применение. Например, фтор используется в производстве полимеров, химической промышленности и стекольной промышленности. Хлор используется в производстве пластмасс, водопроводных труб и различных химических соединений. Бром и йод применяются в производстве фармацевтических препаратов, смазочных материалов и пленок.
Таким образом, изучение строения атомов галогенов имеет огромное значение для различных научных и промышленных областей. Это позволяет улучшить химические синтезы, создавать новые материалы, разрабатывать новые технологии и улучшать качество продукции в различных промышленных сферах.




