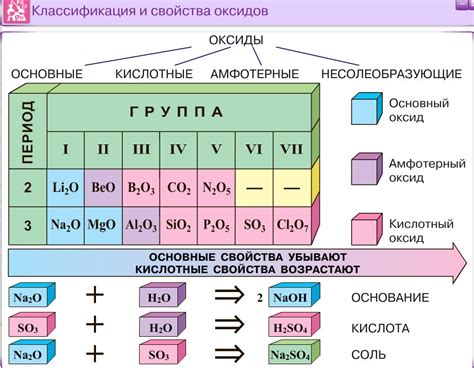
Оксиды - это неорганические химические соединения, состоящие из кислорода и другого элемента. В зависимости от характера другого элемента, оксиды могут быть кислотными или основными. Главное отличие между этими двумя типами оксидов заключается в их химических свойствах и реакциях с другими веществами.
Кислотные оксиды - это оксиды, которые растворяются в воде, образуя кислоты. Они обладают тем свойством, что при контакте с водой они образуют водородные ионные соединения. Кроме того, кислотные оксиды часто проявляют кислотные свойства при реакции с основаниями, образуя соль и воду.
Основные оксиды, напротив, реагируют с водой, образуя основания. Они обладают щелочными свойствами и при взаимодействии с кислотами они образуют соль и воду. Основные оксиды также могут использоваться для нейтрализации кислотных веществ, так как они способны увеличивать рН среды.
Основные свойства кислотных оксидов
Кислотные оксиды проявляют ряд характерных свойств, которые определяют их способность взаимодействовать с водой и образовывать кислоты. Вот основные свойства кислотных оксидов:
1. Кислотное действие: Кислотные оксиды обладают способностью выделять водородные ионны (H+) в растворе, что приводит к образованию кислот. Это связано с высокой электроотрицательностью элемента в оксиде.
2. Кислотный реакция с щелочами: Кислотные оксиды реагируют с щелочными оксидами (основными оксидами), образуя соль и воду. Это называется нейтрализацией и является характерным свойством кислотных оксидов.
3. Кислотное реакция с основаниями: Кислотные оксиды могут реагировать с основаниями (нерастворимыми оксидами) и образовывать соль и воду. Такая реакция также называется нейтрализацией.
4. Коррозионное действие: Кислотные оксиды обладают коррозионными свойствами и способны разрушать различные материалы, в том числе металлы и кожу. Примером такого действия является коррозия металлов при воздействии кислотных оксидов.
Таким образом, кислотные оксиды обладают рядом специфических свойств, которые делают их важными компонентами реакций, связанных с образованием и взаимодействием кислот. Эти свойства определяют их роль и использование в различных процессах и промышленных производствах.
Кислотные оксиды образуются в результате соединения кислорода с радикалами неметаллов
Основным свойством кислотных оксидов является их способность реагировать с водой и образовывать кислоты. При контакте с водой кислотные оксиды образуют кислотные растворы, которые проявляют кислотные свойства.
Важным примером кислотного оксида является диоксид серы (SO2). Он образуется при сгорании серы и имеет сильный запах. Диоксид серы растворяется в воде и образует серную кислоту (H2SO3), которая является кислотным раствором. Также, диоксид серы участвует в атмосферных реакциях и является одним из главных источников кислых дождей.
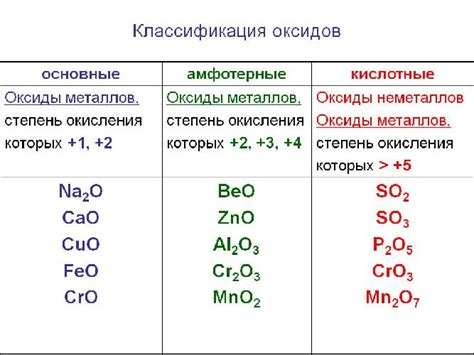
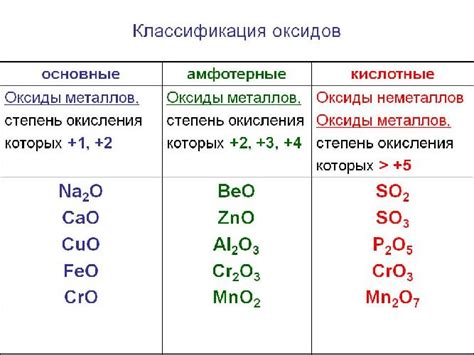
Кроме диоксида серы, существует множество других кислотных оксидов, таких как диоксид углерода (CO2), оксид азота (NO2), оксид фосфора (P2O5) и многие другие. Все они обладают кислотными свойствами и могут образовывать кислотные растворы при взаимодействии с водой.
Кислотные оксиды обладают кислотными свойствами
Когда кислотные оксиды взаимодействуют с водой, происходит химическая реакция, в результате которой образуются кислоты. Эти кислоты обладают кислотным вкусом, способны растворять металлы и имеют кислотную среду.
Кислотные оксиды обычно имеют префикс "кислый" в своем названии. Например, оксид серы ⅵ – кислый оксид серы, оксид азота ⅴ – кислый оксид азота.
Основные свойства кислотных оксидов включают:
- образование кислых растворов при контакте с водой;
- образование кислот при взаимодействии с водой;
- кислотный вкус;
- способность растворять металлы;
- кислотную среду.
Примеры кислотных оксидов:
- Кислый оксид серы – образуется при соединении серы с кислородом. Формула – SO2.
- Кислый оксид азота – образуется при соединении азота с кислородом. Формула – NO2.
- Кислый оксид фосфора – образуется при соединении фосфора с кислородом. Формула – P2O5.
Кислотные оксиды играют важную роль в химических реакциях и применяются в различных сферах науки и промышленности, таких как производство удобрений, кислотных батарей, лакокрасочных материалов и других химических соединений.
Основные свойства основных оксидов
Основные оксиды обладают рядом характерных свойств, отличающих их от кислотных оксидов:
- Они образуют основы, растворяясь в воде. При реакции с водой основные оксиды образуют гидроксиды, которые окрашивают раствор в широкий спектр цветов.
- Основные оксиды обладают щелочными свойствами и могут взаимодействовать с кислотами, образуя соли и воду.
- Они способны нейтрализовать кислоты и образовывать с ними соли. Такие реакции часто сопровождаются выделением тепла и оказываютщщее влияние на pH среды.
- Основные оксиды могут образовывать основания, которые имеют губительное действие на органические материалы, такие как ткани и кожа.
Основные оксиды образуются в результате соединения кислорода с радикалами металлов
Основные оксиды образуются в результате соединения кислорода с радикалами металлов. Радикал металла содержит положительные ионы металла, которые вступают в реакцию с отрицательными ионами кислорода. В результате образуется структура, в которой ионы кислорода окружены положительными ионами металла.
Основные оксиды обычно обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Они также могут реагировать с кислотами, образуя соли. Например, оксид натрия (Na2O) реагирует с серной кислотой (H2SO4) и образует сульфат натрия (Na2SO4).
Основные оксиды имеют широкий спектр применения, особенно в процессах, связанных с производством стекла, шампуней, мыла и других продуктов. Они также играют важную роль в жизнедеятельности организмов, так как являются составной частью многих минералов и веществ в органических системах.




