Сульфат меди 2 – это химическое соединение, которое обладает уникальным свойством изменять цвет при растворении в воде. Обычно этот соединение имеет белый цвет, однако при контакте с водой оно мгновенно приобретает необычное голубое оттенение. Столь необычное явление вызвало интерес ученых, и было проведено множество исследований, чтобы понять причину этой яркой окраски.
Главную роль в появлении голубого цвета играет структура частиц сульфата меди 2. В нерастворенном состоянии эти частицы располагаются в таком порядке, что образуют кристаллическую решетку, которая полностью отражает видимый свет и делает вещество белым. Однако при растворении воде эта структура разрушается, а частицы меди и сульфата распадаются на ионы. Именно ионы меди и сульфата придают раствору голубой цвет.
Вода является уникальной средой для образования химических соединений. Она способна вступать в различные взаимодействия с молекулами веществ, разрушая структуру и вызывая изменение их свойств. В случае с сульфатом меди 2, вода вызывает диссоциацию его молекул, что приводит к появлению ионов меди (Cu2+) и ионов сульфата (SO4^2-). Благодаря именно ионам меди и образуется такой интенсивный голубой цвет раствора.
Причина синей окраски раствора сульфата меди 2

Синяя окраска раствора сульфата меди 2 обусловлена присутствием вещества, известного как купрат. Купрат образуется в результате растворения сульфата меди 2 в воде.
Оксидационно-восстановительные свойства меди приводят к тому, что ионы Cu2+ в растворе претерпевают окисление и восстановление. В реакции окисления медь превращается в ионы Cu2+, а в реакции восстановления окислительным агентом становится Cu2+. Сульфат меди 2, присутствующий в растворе, подвергается таким реакциям.
Купрат обладает необычной окраской из-за спектра поглощения света между 600 и 900 нм. В этом диапазоне длин волн поглощение купрата максимально, что создает закономерное синее поглощение света и синюю окраску раствора.
Изменение концентрации купрата может влиять на интенсивность и оттенок синего цвета раствора сульфата меди 2. Например, более высокая концентрация купрата может дать насыщенный синий цвет, а более низкая концентрация может дать бледный голубой цвет.
Таким образом, причина синей окраски раствора сульфата меди 2 заключается в наличии купрата, который поглощает свет определенных длин волн и отражает синий цвет.
Окислительные свойства сульфата меди 2
Сульфат меди 2 (CuSO4) обладает окислительными свойствами, так как медь в этом соединении находится в ионной форме. Восстановление меди из Cu2+ до Cu+ происходит путем передачи электрона окисляемому веществу. Когда сульфат меди 2 контактирует с окисляемым веществом, окисление происходит на аноде, а медь восстанавливается на катоде.
Результатом восстановления меди может быть образование меди, обволакивающей поверхность анода. Эта медь может иметь голубой цвет. Чем больше меди образуется на аноде, тем интенсивнее цвет раствора сульфата меди 2.
Не только на видимых поверхностях проявляются окислительные свойства сульфата меди 2. Внутри раствора ионы Cu2+ также могут вступать в окислительные реакции. Они могут окислять другие ионы или молекулы, передавая свои электроны и переходя в более низкую химическую форму.
Окислительные свойства сульфата меди 2 приводят к изменению цвета раствора. При взаимодействии сульфата меди 2 с веществами, способными вступать в окислительные реакции, ионы меди переходят в более низкую степень окисления, образуя ионы меди 1 (Cu+) или осадок меди. При этом происходит изменение цвета раствора сульфата меди 2, который становится голубым.
Еффект медного иона
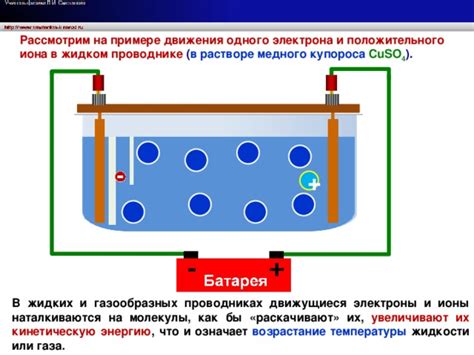
Почему раствор сульфата меди 2 становится голубым можно объяснить через эффект медного иона. Сульфат меди 2 (CuSO4) в водном растворе диссоциирует на ионы меди (Cu2+) и сульфата (SO42-). Именно ионы меди в растворе придают ему голубой цвет.
Когда свет падает на раствор сульфата меди 2, ионы меди поглощают некоторые длины волн света, в основном в области длинных волн видимого спектра. При этом происходит переход электронов из нижних энергетических уровней на более высокие уровни. Голубой цвет раствора является результатом обратного рассеяния поглощенного света, когда электроны возвращаются на нижние энергетические уровни и излучают свет.
Интересно, что цвет раствора может меняться в зависимости от его концентрации и от окружения. Высокая концентрация или присутствие других компонентов могут изменить энергию перехода электронов, что приведет к изменению цвета раствора. Эффект медного иона является одним из множества примеров, демонстрирующих эффекты химических реакций на видимый свет и цвет вещества.
Формирование комплексного соединения
Комплексные соединения – это соединения, в которых металл и другие атомы или группы атомов, называемые лигандами, образуют сильные связи. В случае с сульфатом меди 2, основными лигандами могут быть водные молекулы.
Медь в растворе сульфата меди 2 может образовывать комплексные ионные соединения с водными молекулами. Такие соединения имеют обычно голубой цвет. Формирование комплексных соединений меди 2 с водными молекулами приводит к сдвигу в электронном спектре сульфата меди 2 в область видимого света.
Комплексное соединение меди 2 с водными молекулами можно представить с помощью химической формулы [Cu(H2O)6]2+. В этой формуле медь представлена в двухвалентной форме Cu2+, а водные молекулы – лиганды – обозначены включением в круглые скобки.
Формирование комплексных соединений меди 2 обусловлено способностью меди образовывать кратные связи. Водные молекулы могут быть привлечены к ионам меди через кислородный атом, образуя стабильный комплексный ион.
Расщепление сульфата меди 2

Когда сульфат меди 2 растворяется в воде, молекулы сульфата меди разделяются на ионы меди (Cu2+) и ионы сульфата (SO4^2-). Ионы меди обладают синей окраской, поэтому раствор становится голубым. Это свойство сульфата меди 2 делает его популярным в химических опытах и использовании в качестве красителя.
Интересно отметить, что раствор сульфата меди 2 может менять свой цвет в зависимости от концентрации, pH и наличия других веществ. Например, при добавлении некоторых веществ раствор может становиться зеленым или фиолетовым.
Таким образом, голубая окраска раствора сульфата меди 2 свидетельствует о присутствии ионов меди и о процессе расщепления сульфата меди 2 на составляющие ионы.
Изменение спектральных свойств раствора
Раствор сульфата меди 2 обладает уникальными спектральными свойствами, в результате которых он приобретает голубой цвет. Это явление объясняется наличием ионов меди в растворе.
Ионы меди в растворе взаимодействуют с светом, поглощая определенные длины волн. Такие ионы способны поглощать свет в видимом диапазоне спектра, особенно длины волн, соответствующие цвету оранжевого и красного. Это свойство ионов меди называется селективным поглощением.
При поглощении света ионы меди переходят на более высокие энергетические уровни, а затем возвращаются на исходные уровни, испуская фотоны. При этом происходит изменение спектра поглощения и испускания. Вследствие этих процессов раствор сульфата меди 2 приобретает голубой цвет.
Цвет раствора зависит от концентрации ионов меди в нем. Более высокая концентрация ионов приводит к более насыщенному голубому цвету раствора. Кроме того, pH раствора также может влиять на его цвет, поскольку изменения кислотности могут повлиять на взаимодействие ионов меди с другими веществами в растворе.
Очень важно отметить, что изменение спектральных свойств раствора сульфата меди 2 полностью обратимо. При удалении ионов меди из раствора, цвет становится прозрачным, теряет голубой оттенок. Это позволяет использовать раствор сульфата меди 2 в различных промышленных и научных процессах, где нужно контролировать изменение цвета раствора.
Взаимодействие со светом

В сульфате меди 2 содержится ион меди 2+, который имеет ярко-голубой цвет. Когда ион меди 2+ распределяется равномерно в растворе, он поглощает свет в определенных длинах волн, отражая только голубой спектр. Это и является причиной голубого окраса раствора сульфата меди 2.
Свет, проходящий через раствор, проходит через молекулы сульфата меди 2, и его цвет изменяется. Некоторые из длинных волн света поглощаются молекулами, а короткие волны проходят через раствор без изменений. Таким образом, голубой цвет становится более интенсивным и насыщенным.
Интересно также отметить, что цвет раствора сульфата меди 2 может изменяться в зависимости от концентрации раствора. С повышением концентрации количество ионов меди 2+ увеличивается, что влияет на интенсивность и насыщенность голубого цвета раствора.
Влияние окружающей среды
Цвет раствора сульфата меди 2 зависит от его окружающей среды. В нормальных условиях вода и воздух не оказывают существенного влияния на цвет раствора. Но если в раствор добавить аммиачную соль или аммиак, цвет раствора изменится на голубой.
Это происходит потому, что аммиачные соединения образуют комплексы с ионами меди 2. Новообразованные комплексы обладают специфическими оптическими свойствами, которые обусловливают их голубой цвет. При этом в растворе происходит химическая реакция образования гидроксида меди(II), который является основанием синего цвета.
Таким образом, окружающая среда, содержащая аммиак или его соединения, может вызвать изменение цвета раствора сульфата меди 2 на голубой.
Практическое применение

Процесс осаждения меди позволяет создавать подкладки или покрытия из меди на различных поверхностях, таких как металлы или пластик. Этот процесс находит широкое применение в производстве электронных компонентов, таких как микрочипы и платы схем.
Кроме того, раствор сульфата меди 2 может применяться как каталитический агент в различных химических реакциях. Он может использоваться для активации реагентов и ускорения химических процессов. Это свойство находит применение в промышленности, особенно в области производства пластмасс, красителей и фармацевтических препаратов.
Кроме того, равновесие между ионами меди 2+ и ионами гидроксида обуславливает устойчивость раствора и его способность к применению в лабораторных исследованиях. Раствор сульфата меди 2 может использоваться, например, для определения содержания хлорида в образце с помощью метода Мохра. Такой аналитический метод может быть применен для контроля качества воды, почвы и других сред, а также для анализа различных проб в химической промышленности.




