Химия – это наука о веществах, их составе, структуре и свойствах. В химии существует понятие "простого вещества", которое отличается особыми характеристиками и статусом.
Простое вещество – это вещество, состоящее из одного вида атомов или молекул. Оно не может быть разложено на составные компоненты с помощью химических реакций. Все простые вещества обладают характерными химическими и физическими свойствами, которые определяются их атомной или молекулярной структурой.
Простые вещества можно разделить на два основных типа: элементы и соединения. Элементы – это простые вещества, состоящие из атомов одного вида. В нашей природе известно около 118 элементов, каждый из которых имеет свое название, атомный номер и химический символ. Некоторые элементы, такие как железо, углерод и кислород, широко распространены в природе и играют важную роль в нашей жизни.
Соединения – это простые вещества, состоящие из атомов или молекул разных элементов, связанных химическими связями. Соединения образуются путем химических реакций между элементами. Некоторые известные соединения включают воду (H2O), углекислый газ (CO2) и соль (NaCl). Каждое соединение имеет уникальные свойства, зависящие от его состава и структуры.
Определение простых веществ
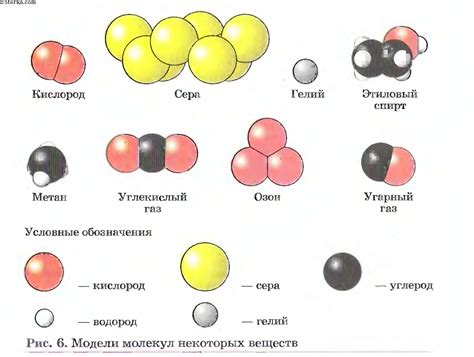
Простыми веществами в химии называются вещества, состоящие из одного вида атомов. Они не могут быть разложены на более простые вещества с помощью химических реакций.
Основные представители простых веществ - это химические элементы. Каждый элемент имеет свою уникальную атомную структуру, определяющую его свойства и химическую активность.
Простые вещества могут существовать в разных физических состояниях - газообразном, жидком или твердом. Некоторые из них являются металлами, а другие - неметаллами.
Простые вещества играют важную роль в химических реакциях и образовании соединений. Они могут быть использованы в различных областях науки и техники, например, в производстве материалов, в электронике и медицине.
- Примеры простых веществ:
- Кислород (O)
- Углерод (C)
- Водород (H)
- Железо (Fe)
- Алюминий (Al)
- Золото (Au)
Химические элементы
Периодическая таблица элементов включает в себя все известные нам химические элементы, от самых легких до самых тяжелых. Каждый элемент имеет уникальный атомный номер, который определяет его расположение в таблице. Некоторые элементы названы в честь известных ученых, стран или даже мифологических существ.
Химические элементы представлены символами, обычно состоящими из одной или двух латинских букв. Например, кислород обозначается символом "O", а железо - символом "Fe". Кроме символа, элементы также имеют атомную массу, которая показывает общее количество протонов и нейтронов в атоме элемента.
Химические элементы играют важную роль в химии и имеют широкий спектр применений в различных областях. Они используются в производстве материалов, электронных устройств, лекарств и многих других продуктов. Изучение и понимание химических элементов помогает ученым разрабатывать новые материалы и улучшать существующие процессы.
Всего в природе существует около 118 химических элементов, из которых 92 встречаются в природе, а остальные получаются искусственным путем. Познание этих элементов позволяет углубить наше понимание мира и расширить наши возможности в области науки и технологий.
Аллотропные формы

Наиболее известными аллотропами являются кислород, углерод и фосфор.
- Кислород может существовать в трех аллотропных формах: озоне, кислороде и окиси дифтора.
- Углерод имеет несколько аллотропных форм: графит, алмаз, фуллерены и нанотрубки.
- Фосфор также обладает различными аллотропными формами: белый, красный и черный фосфор.
Каждая аллотропная форма характеризуется своими физическими и химическими свойствами. Например, алмаз является твердым и прозрачным веществом, в то время как графит – мягкий и проводящий электричество материал.
Изучение аллотропных форм важно для понимания свойств и возможностей различных веществ, а также для применения их в различных сферах науки и техники.
Одноатомные газы
Одноатомные газы включают такие элементы, как хлор (Cl), гелий (He), неон (Ne), криптон (Kr), аргон (Ar), ксенон (Xe), радон (Rn), и др. Эти элементы обладают устойчивыми атомами и являются инертными газами, то есть они практически не взаимодействуют с другими веществами.
Одноатомные газы широко используются в различных областях науки и техники. Например, гелий применяется в аэростатике для заполнения воздушных шаров, так как он обладает малой плотностью и не поддается горению. Аргоны и криптоны используются в сварочных работах для защиты металлов от окисления.
Одноатомные газы также имеют широкое применение в осветительной технике и электронике. Например, неоновые лампы используются для создания рекламных вывесок и электрического освещения. Ксеноновые лампы применяются в автомобильных фарах для повышения яркости света. Радон, хотя и является радиоактивным элементом, используется в медицинских целях для радоновой балнеологии и радоновых ванн.
Таким образом, одноатомные газы представляют собой уникальные вещества, которые имеют важное значение в различных областях науки, техники и медицины. Их свойства и применение позволяют использовать их в различных технологиях и процессах, а также сделать их неотъемлемой частью современной жизни.
Простые вещества с полиморфизмом
Полиморфизм обозначает способность простых веществ существовать в различных аллотропных формах или морфологических модификациях. Это означает, что химические свойства этих веществ остаются одинаковыми, но их структура и физические свойства могут значительно отличаться.
Примерами простых веществ с полиморфизмом являются карбонат кальция (CaCO3) и кислород (O2). Кристаллический карбонат кальция может существовать в трех формах: кальцит, арагонит и ватерит. Каждая из этих форм имеет уникальные структурные особенности и физические свойства.
Кислород также обладает полиморфизмом и может существовать в двух формах: кислородной молекуле (O2) и озоне (O3). Обе формы кислорода имеют различные структуры и физические свойства, но они обладают теми же химическими свойствами.
Полиморфизм в простых веществах является результатом различных условий окружающей среды, таких как температура и давление. Изучение полиморфизма важно для понимания структурных и физических свойств материи, а также для его применения в различных областях науки и промышленности.
| Простое вещество | Полиморфные формы |
|---|---|
| Карбонат кальция | Кальцит, арагонит, ватерит |
| Кислород | Кислородная молекула, озон |
Неорганические соединения
Некоторые из наиболее распространенных неорганических соединений включают соли, оксиды, карбиды, нитриды, фосфиды и сульфиды. Соли являются наиболее известными неорганическими соединениями и образуются при реакции кислот и оснований. Оксиды - это соединения, состоящие из кислорода и других элементов. Карбиды содержат углерод и другие элементы, такие как кремний или бор. Нитриды, фосфиды и сульфиды содержат азот, фосфор и серу соответственно.
Неорганические соединения широко используются в промышленности и в нашей повседневной жизни. Например, многие металлы, такие как железо и алюминий, широко используются в производстве строительных материалов, автомобилей и электроники. Различные соли используются в пищевой промышленности для придания вкуса и сохранения свежести продуктов.
Изучение неорганических соединений важно для понимания многих химических процессов и развития новых материалов и технологий. Неорганическая химия играет важную роль в различных отраслях науки и промышленности, включая фармацевтику, энергетику, экологию и сельское хозяйство.
| Примеры неорганических соединений: | Описание |
|---|---|
| Соляная кислота | Сильная минеральная кислота, используется в лабораториях и промышленности |
| Карбонат кальция | Основной компонент мрамора и известняка |
| Аммиак | Газообразное соединение, используется в производстве удобрений и чистящих средств |
| Диоксид кремния | Основной компонент песка и стекла |
Органические соединения
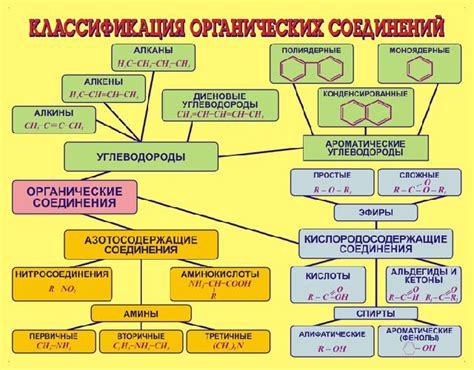
Органические соединения могут быть обнаружены во множестве природных и искусственных материалов. Примеры органических соединений включают углеводы, липиды, белки и нуклеиновые кислоты.
Основные элементы, которые могут образовывать органические соединения, включают углерод, водород, кислород, азот и фосфор. Они могут соединяться между собой и с другими элементами, образуя сложные структуры и функциональные группы.
Органические соединения могут быть безцветными или иметь различные цвета, а также различаться в запахе и вкусе. Они часто являются химически активными и могут участвовать в различных реакциях и процессах.
Важно отметить, что органические соединения и их свойства могут значительно различаться в зависимости от атомной структуры, функциональных групп и других факторов. Изучение органических соединений и их свойств является одной из основных областей органической химии.
Простые ионы
Простые ионы обладают электрическим зарядом, который может быть положительным или отрицательным. Положительные простые ионы называют катионами, а отрицательные - анионами.
Примерами простых ионов являются ионы натрия (Na+), ионы хлора (Cl-), ионы кальция (Ca2+) и т.д.
Простые ионы имеют важное значение в химии, так как они участвуют в химических реакциях и формируют растворы с определенными свойствами. Ионы также являются основными составляющими частями солей и многих других соединений.
Соединения двух элементов
В химии существуют различные типы соединений, включая так называемые двухэлементные соединения. Это вещества, состоящие из атомов двух разных химических элементов, которые связаны друг с другом.
В таких соединениях каждый элемент играет свою роль и может вносить свойственные ему химические и физические характеристики. Комбинация двух элементов может приводить к образованию различных соединений, которые могут иметь разные свойства и использоваться в различных областях.
Примером двухэлементных соединений являются такие вещества, как вода (H2O), соль (NaCl), аммиак (NH3) и углекислый газ (CO2). Вода состоит из атомов водорода (H) и кислорода (O), соль – из атомов натрия (Na) и хлора (Cl), а аммиак – из атомов азота (N) и водорода (H).
Соединения двух элементов могут иметь важное значение для многих процессов и являться основой для создания различных продуктов и материалов. Например, вода необходима для жизни на Земле и используется в различных отраслях, а соль является неотъемлемой частью пищевой промышленности.
Таким образом, двухэлементные соединения являются важными и широко распространенными в химии веществами, которые играют важную роль в ежедневной жизни и различных областях науки и промышленности.




