Анилин - это органическое соединение, которое относится к классу аминоароматических соединений. С молекулярной формулой C6H5NH2, анилин входит в состав множества промышленных и научных продуктов, таких как красители, пластик, лекарства и другие. Одно из интересных свойств анилина заключается в его нерастворимости в воде.
Анилин не реагирует с водой из-за строения его молекулы. Вода является полярным растворителем, то есть молекулы воды обладают дипольным моментом. В то время как молекулы воды состоят из атомов кислорода и водорода, анилин содержит атомы углерода, азота и водорода.
Однако, несмотря на отсутствие реакции с водой, анилин может растворяться в других органических растворителях, таких как этиловый спирт или бензол. Это объясняется тем, что анилин содержит ароматическое кольцо, которое обладает свойством образовывать силные взаимодействия с другими ароматическими соединениями.
Реакция анилина с водой: почему она не происходит?
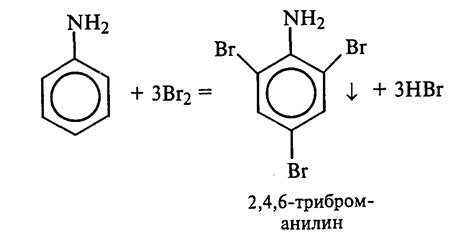
Причина отсутствия реакции анилина с водой заключается в его особой структуре. Анилин содержит ароматическое кольцо бензола, к которому прикреплена амино группа NH₂. Ароматические кольца обладают стабильной электронной структурой, которая делает их малоактивными к химическим реакциям. Это связано с наличием сопряженных пи-электронных облаков в ароматическом кольце, которые предотвращают аддицию веществ, таких как вода.
Кроме того, амино группа NH₂ в анилине является неактивной. В отличие от аминов, содержащих простые амино группы (NH₂), амино группа в анилине связана с ароматическим кольцом, что делает ее менее доступной для электрофильной атаки. Вода не обладает достаточной электрофильностью, чтобы разорвать эту связь и вступить в реакцию с анилином.
Таким образом, вода не способна растворять анилин или претерпевать химические реакции с ним из-за стабильности ароматического кольца и неактивности амино группы в анилине. Вместо этого, анилин взаимодействует с другими реагентами, такими как кислоты или хлорные растворы, где может происходить реакция с амино группой.
Структура молекулы анилина
Молекула анилина состоит из шестиугольного ароматического кольца, в котором углеродные атомы чередуются с атомами водорода. На одном из углеродных атомов этого кольца находится аминогруппа, состоящая из атома азота и трех атомов водорода.
В анилине ароматическое кольцо и аминогруппа связаны друг с другом через углеродный атом.
Структура молекулы анилина обусловливает его физические и химические свойства. Одной из особенностей анилина является его низкая реактивность с водой.
Особенности химической связи в молекуле анилина
Аминоароматическая связь в молекуле анилина является более стабильной и прочной, чем обычная аминовая связь. Это связано с наличием электронных облаков пи-электронных облаков в ароматическом кольце. Пи-электроны образуют систему сопротивления, которая стабилизирует аминоароматическую связь и делает ее более прочной.
Благодаря стабильности аминоароматической связи, молекула анилина обладает химической инертностью. Это означает, что анилин не реагирует с водой или другими реагентами так легко, как, например, альдегиды или алкены.
Однако, несмотря на инертность анилина, он может участвовать в реакциях, подходящих для аминоароматических соединений. Например, анилин может претерпевать ацилирование или алкилирование, где ацетильная или алкильная группы замещают атом водорода в молекуле анилина. Также, анилин может претерпевать окисление, ароматическую нитрацию и другие реакции, характерные для соединений с аминоароматическими связями.
Взаимодействие анилина с водой на молекулярном уровне
Химическое взаимодействие анилина с водой обусловлено свойствами молекул этих веществ. Водная молекула состоит из двух атомов водорода (Н) и одного атома кислорода (О). Кислородный атом обладает электронной плотностью и является отрицательным, в то время как водородные атомы положительно заряжены.
Механизм взаимодействия анилина с водой:
При контакте с водой анилин не проявляет реактивности из-за наличия электронной плотности на атоме азота (N) и электроотрицательности атомов азота и водорода (N и H соответственно). Это приводит к образованию межмолекулярных водородных связей между азотом анилина и водными молекулами. Такое взаимодействие называется образованием гидратов анилина.
Гидраты анилина – комплексные соединения, в которых один или несколько молекул анилина связаны с молекулами воды с помощью водородных связей. Образование гидратов анилина позволяет анилину сохранять в своей структуре нейтральность и устойчивость.
Таким образом, анилин не реагирует с водой на молекулярном уровне из-за образования гидратов и нейтральности его структуры. Это свойство анилина является существенным при его применении в различных химических и фармацевтических процессах.
Ионизация анилина в водном растворе
Однако, анилин не реагирует с водой обычным способом, то есть не происходит ионизация его молекулы в водном растворе. Это связано с тем, что амино-группа в анилине обладает низкой активностью и находится в более закрытом положении, по сравнению с простыми амино-соединениями.
Ионизация анилина в водном растворе может происходить с помощью сильных кислот или щелочей, которые вызывают протекание реакции:
C6H5NH2 + H2O → C6H5NH3+ + OH-
Таким образом, чтобы ионизировать анилин в водном растворе, необходимо воздействие внешних факторов, таких как кислоты или щелочи, способных разрушить структуру анилина и обеспечить процесс ионизации.
Понимание процесса ионизации анилина в водном растворе имеет практическое значение в химической и фармацевтической промышленности при синтезе органических соединений.
Взаимодействие анилина с молекулами воды в растворе
Молекулы воды, с другой стороны, являются полярными и образуют гидратные оболочки вокруг ионов и других полярных молекул. У анилина отсутствуют полярные группы, которые могут формировать водородные связи с молекулами воды. Поэтому молекулы анилина не образуют устойчивых водородных связей с молекулами воды.
Когда анилин добавляется в воду, он образует две фазы - органическую и водную. Анилин сконцентрирован в органической фазе, в то время как в водной фазе присутствует только остаточное количество. Это называется нерастворимостью анилина в воде.
Таким образом, взаимодействие анилина с молекулами воды в растворе ограничивается слабым взаимодействием, вызванным гидратацией поверхности анилина в водной фазе. Однако это взаимодействие не достаточно сильное для образования стабильного раствора анилина в воде.
Гидролиз анилина в щелочной среде
Однако анилин не реагирует с водой при обычных условиях. Это связано с особенностями его структуры и электрохимических свойств. Молекула анилина содержит аминогруппу (-NH2), которая является слабым основанием.
Гидролиз анилина возможен только в присутствии сильной щелочи, например, натрия гидроксида (NaOH). В щелочной среде анилин проявляет щелочные свойства и реагирует с водой, образуя соль анилина и аммиак:
| Реакция гидролиза анилина в щелочной среде: |
|---|
| C6H5NH2 + H2O → C6H5NH3+ + OH- |
| C6H5NH2 + H2O → C6H5NH3+ + OH- |
В результате гидролиза образуется соль анилина (C6H5NH3+) и гидроксидный ион (OH-), который даёт раствору щелочную реакцию.
Гидролиз анилина в щелочной среде может использоваться для получения солей анилина, которые широко применяются в органическом синтезе и других химических процессах.
Таким образом, гидролиз анилина в щелочной среде является важной реакцией, позволяющей получить соли анилина и аммиак.
Кинетические особенности реакции анилина с водой
Вода является слабым нуклеофилом и плохим электрофилом, поэтому прямая реакция анилина с водой затруднена. За реакцию с анилином могут конкурировать более сильные нуклеофилы, такие как гидроксид или амин гидроксидного происхождения.
Другой фактор, влияющий на отсутствие прямой реакции анилина с водой, - это образование промежуточного аниона. Анилин имеет слабую основность, поэтому его депротонирование для образования анионного промежуточного состояния происходит сравнительно медленно. Вследствие этого скорость реакции анилина с водой очень низкая.
Обратная реакция анилина с водой, где анилин является электрофилом, а вода - нуклеофилом, происходит быстро и эффективно. В результате этого образуется гидроксилная группа (-OH) в позиции орто или парамы, в зависимости от условий проведения реакции.
В целом, реакция анилина с водой имеет сложный механизм и зависит от ряда факторов, таких как pH, температура и наличие катализаторов. Понимание кинетических особенностей этой реакции позволяет контролировать процессы модификации и синтеза анилина в химической промышленности и области органической химии.
Практическое применение анилина и его нереактивность с водой

Практическое применение анилина связано с его свойствами, такими как высокая растворимость в органических растворителях, способность образовывать соли и сильные кислоты. Также, анилин является исходным веществом для получения различных органических соединений.
Однако, анилин не реагирует с водой, что является его недостатком во многих сферах применения. Эта нереактивность обусловлена наличием амино-группы (NH2) в молекуле анилина, которая не способна связываться с молекулами воды.
Несмотря на это, анилин находит свое применение в производстве красителей, лекарственных препаратов, пластиков, синтетических волокон и других продуктов. Его способность образовывать соли позволяет использовать анилин в качестве кистообразующего компонента в краске, а его растворимость в органических растворителях делает его ценным ингредиентом в различных химических реакциях и синтезе органических соединений.
Таким образом, несмотря на нереактивность анилина с водой, его практическое применение в различных отраслях промышленности и исследовательских работах делает его важным органическим соединением.




