Процесс перемешивания воды и спирта является одним из наиболее изученных явлений в химии и физике. Оба вещества являются поларными и обладают своими природными свойствами, которые влияют на способ перемешивания. Несмотря на то, что вода и спирт являются разными веществами, их смешение может происходить под определенными условиями, что представляет значительный интерес для научного сообщества.
Основная причина перемешивания воды и спирта заключается в их наличии полюсов и создании водородных связей. Вода, являющаяся полюсным молекулой, образует водородные связи с другими молекулами воды и оказывается способной образовывать взаимодействия с молекулами спирта. Спирт, в свою очередь, содержит гидроксильную группу, которая также может участвовать в образовании водородных связей.
Механизм перемешивания воды и спирта заключается в двух основных процессах: дисперсии и диффузии. В процессе дисперсии молекулы спирта и воды распадаются на более мелкие частицы и перемешиваются в равномерную смесь. Диффузия, в свою очередь, представляет собой движение молекул от области с более высокой концентрацией к области с более низкой концентрацией, что приводит к равномерному распределению воды и спирта в смеси.
Причины перемешивания воды и спирта

Взаимодействие воды и спирта происходит благодаря ряду физико-химических процессов, связанных с их молекулярной структурой и взаимным притяжением. Существуют несколько основных причин перемешивания воды и спирта:
| Причина | Описание |
|---|---|
| Слабая поларность спирта | Спирт обладает слабой полярностью, что позволяет ему взаимодействовать как с поларными, так и с неполярными веществами. Вода, с другой стороны, является поларным веществом. При перемешивании воды и спирта происходит притяжение положительных и отрицательных частей молекул, что обеспечивает образование смеси. |
| Водородная связь | Вода обладает способностью образовывать водородные связи между молекулами. Спирт также может образовывать водородные связи. Взаимодействие водородных связей воды и спирта способствует их перемешиванию. |
| Теплопроводность | Вода и спирт оба являются хорошими проводниками тепла. При перемешивании этих веществ происходит перераспределение тепла, что способствует равномерному и быстрому смешению воды и спирта. |
| Осмотический давление | Различное осмотическое давление воды и спирта может способствовать их перемешиванию. Осмотическое давление создает разность концентраций, что приводит к движению молекул вещества и его смешению. |
Таким образом, причины перемешивания воды и спирта связаны с их химическими свойствами и взаимодействием на молекулярном уровне. Эти факторы обеспечивают образование однородной смеси воды и спирта при их перемешивании.
Различия в молекулярной структуре
Причина различий в перемешивании воды и спирта лежит в их молекулярной структуре.
Молекулы воды состоят из двух атомов водорода и одного атома кислорода, связанных ковалентными связями. Угол между связями составляет около 104.5 градусов.
Спирты, в свою очередь, содержат в своей структуре гидроксильную группу (OH). Молекулы спирта могут быть одноатомными, как в случае с метанолом (CH3OH), или иметь более сложную структуру, например, этиловый спирт (C2H5OH).
Наиболее важным различием между водой и спиртом является полюсность молекул. Вода является полярным соединением, так как атомы водорода и кислорода имеют разные электроотрицательности и образуют диполи. В то время как спирты также содержат полюсные группы (OH), их молекулы обычно не так поларизованы, как молекулы воды.
Это различие в полюсности молекул определяет различия в их поведении при смешивании. Вода и спирты могут взаимодействовать друг с другом, образуя водородные связи, однако такие связи являются менее стабильными в случае смешивания воды и спирта, чем в случае смешивания воды с другой молекулой воды.
Такие различия в молекулярной структуре также влияют на физические свойства воды и спирта, такие как температура плавления и кипения, плотность, вязкость и т.д.
Способы разделения воды и спирта
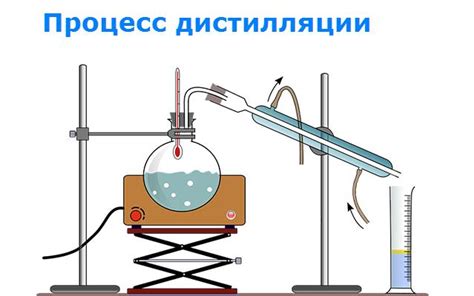
1. Дистилляция
Дистилляция - это один из самых распространенных способов разделения смеси воды и спирта. Он основан на различиях в их температурных точках кипения. В процессе дистилляции, смесь нагревается до определенной температуры, при которой спирт испаряется, а вода остается в жидком состоянии. Затем пары спирта попадают в конденсатор, где они охлаждаются и снова становятся жидкостью. Это позволяет собирать очищенный спирт, в то время как вода остается в остатке.
2. Выпаривание
Выпаривание - это метод разделения смеси, в котором смесь нагревается до высокой температуры, чтобы спирт испарился, а вода осталась. Затем пары спирта конденсируются и собираются, оставив воду в остатке. Этот метод особенно полезен для разделения смесей с низкой концентрацией спирта.
3. Использование ионообменной смолы
Ионообменная смола - это специальный материал, который обладает способностью селективно ионообменного вещества. При передаче смеси через слой ионообменной смолы, спирт и вода могут разделиться. Этот метод обычно используется в промышленных процессах очистки и разделения воды и спирта.
4. Адсорбция смолами
Адсорбция смолами - это процесс, при котором спирт и вода разделяются с помощью специальных адсорбционных смол. Эти смолы способны адсорбировать определенные компоненты смеси, в то время как другие остаются нерасчлененными. После прохождения через слой адсорбционной смолы, спирт и вода разделяются, их можно легко извлечь из смолы и собрать в отдельные фракции.
Каждый из этих методов имеет свои преимущества и недостатки и может быть использован в различных ситуациях, в зависимости от требуемой степени разделения и доступных ресурсов.
Влияние температуры на перемешивание
Температура играет важную роль в процессе перемешивания воды и спирта. Повышение температуры может ускорить или замедлить процесс перемешивания в зависимости от химических свойств веществ.
При повышении температуры молекулы вещества получают больше энергии и начинают двигаться быстрее. Это увеличивает тепловое движение молекул и способствует их осаждению, что снижает эффективность перемешивания.
Однако, в некоторых случаях повышение температуры может увеличить межмолекулярные взаимодействия и ускорить процесс перемешивания. Например, в случае смешивания воды и этилового спирта при повышенных температурах происходит увеличение скорости перемешивания веществ.
Также тепло имеет влияние на плотность веществ. При нагревании вещества расширяются, что может изменить скорость перемешивания. Например, при перемешивании воды и спирта при разных температурах также происходит изменение плотности вещества, что влияет на смешивание.
Таким образом, температура оказывает существенное влияние на процесс перемешивания воды и спирта. Для оптимального перемешивания важно учитывать химические свойства веществ и выбирать соответствующую температуру, которая обеспечит максимальную эффективность смешивания.
Механизмы перемешивания воды и спирта
Один из основных механизмов перемешивания воды и спирта - молекулярная диффузия. Молекулы воды и спирта движутся вокруг друг друга, образуя перемешанное пространство. Молекулы перемещаются из области с более высокой концентрацией в область с более низкой концентрацией, что способствует равномерному перемешиванию.
Еще одним механизмом перемешивания является конвекция. При перемешивании воды и спирта происходит образование конвекционных потоков, вызванных разницей плотности двух жидкостей. Более легкая спиртовая среда поднимается вверх, а тяжелая водная среда опускается вниз, образуя вихри и турбулентные потоки. Эти движения способствуют смешиванию двух жидкостей.
Также важную роль в процессе перемешивания играют поверхностные натяжения между водой и спиртом. Возникающие силы поверхностного натяжения препятствуют перемешиванию двух жидкостей, формируя границы между ними. Однако, с помощью механического воздействия, такого как растяжение или размешивание, силы поверхностного натяжения могут быть нарушены, что способствует перемешиванию воды и спирта.
В целом, перемешивание воды и спирта - это сложный процесс, в котором совместно действуют молекулярная диффузия, конвекция и поверхностное натяжение. Знание механизмов перемешивания позволяет понять, как происходит равномерное распределение двух жидкостей и применять эту информацию в различных областях, таких как фармацевтика, химия и косметология.
Электростатическое взаимодействие
Молекулы воды состоят из атомов кислорода и водорода, причем кислород обладает более высокой электроотрицательностью, чем водород. Это приводит к образованию положительного и отрицательного зарядов на атомах воды.
Молекулы спирта также обладают положительными и отрицательными зарядами, но в меньшей степени. Это обусловлено различным химическим строением спирта.
Когда вода и спирт смешиваются, заряженные частицы притягиваются друг к другу благодаря электростатическому взаимодействию. Они образуют водородные связи, которые стабилизируют смесь и предотвращают разделение на две фазы.
Электростатическое взаимодействие также играет роль в процессе диссоциации и ионизации молекул воды и спирта. Вода может диссоциировать на ионы водорода (H+) и гидроксидные ионы (OH-). Спирт может ионизироваться на ионы аммония (NH4+) и ионы гидроксидных (OH-).
Электростатическое взаимодействие между ионами и диполями воды и спирта играет важную роль в химических процессах, происходящих в реакциях растворения, реакциях гидролиза и реакциях окисления-восстановления.
Водородные связи
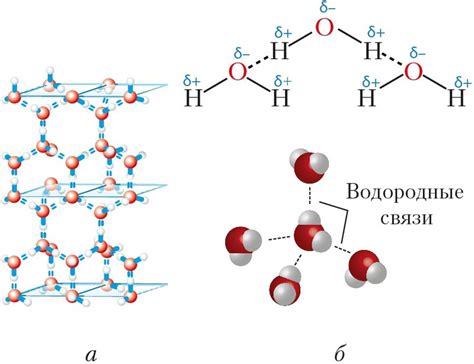
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Все три атома лежат в одной плоскости, и между ними возникают взаимодействия через водородные связи. Кислородный атом притягивает электроны водородных атомов с такой силой, что создается положительный заряд на водородных атомах и отрицательный заряд на кислородном атоме. Эти заряды и приводят к возникновению водородных связей.
В процессе перемешивания воды и спирта, водородные связи играют роль катализатора. Молекулы спирта содержат группы -ОН, которые являются активными центрами для образования водородных связей с молекулами воды. Это приводит к образованию крупных кластеров спирта и воды, которые перемешиваются и образуют однородный раствор.
Водородные связи также являются важным фактором в растворении различных веществ в воде. Молекулы с положительно заряженными группами могут образовывать водородные связи с отрицательно заряженными атомами кислорода в молекулах воды. Это способствует растворению этих веществ в водной среде и созданию стабильной смеси.
Таким образом, водородные связи играют важную роль в перемешивании воды и спирта, а также в растворении различных веществ в воде. Это явление облегчает образование гомогенных растворов и способствует установлению равновесия между водой и спиртом.
Силы ван-дер-Ваальса
Силы ван-дер-Ваальса возникают из-за непостоянства электронной оболочки атомов и молекул. Когда две молекулы находятся на расстоянии друг от друга, электронные облака одной молекулы временно искажают электронные облака другой молекулы. Это приводит к появлению моментальных диполей, которые в свою очередь притягиваются друг к другу.
Силы ван-дер-Ваальса действуют между молекулами воды и молекулами спирта, влияя на их взаимодействие и перемешивание. Когда вода и спирт смешиваются, молекулы образуют новые связи, которые стабилизируют систему и позволяют образованию равновесия.
Уникальность сил ван-дер-Ваальса заключается в их слабости по сравнению, например, со сцеплением атомов или силами электростатического взаимодействия. Однако, когда много молекул силами ван-дер-Ваальса взаимодействуют между собой, суммарное влияние этих сил становится значительным. Именно поэтому силы ван-дер-Ваальса играют ключевую роль в перемешивании воды и спирта.
Различия в свойствах воды и спирта
- Различие в плотности: Вода является более плотной жидкостью по сравнению со спиртом. Это означает, что при смешивании вода будет оставаться внизу, а спирт - сверху.
- Температура замерзания и кипения: У воды более высокая температура замерзания и кипения по сравнению со спиртом. Вода замерзает при 0 градусов Цельсия и кипит при 100 градусов Цельсия, тогда как спирт замерзает при -114 градусов Цельсия и кипит при 78 градусах Цельсия.
- Растворимость: Вода обладает высокой растворимостью и может растворять множество веществ, включая спирт. Однако спирт ограничен в своей растворимости, и не может полностью растворить воду.
- Полярность: Вода является полярным растворителем, в то время как спирт является слабо полярным растворителем. Это означает, что вода смешивается лучше с другими полярными веществами, в то время как спирт будет лучше смешиваться с неполярными веществами.
- Вода - жизненно необходимая жидкость: Вода является не только важным растворителем и средой для многих биологических процессов, но и основным компонентом всех организмов. Спирт, несмотря на свои широко используемые свойства в медицине и промышленности, является веществом, которое необходимо употреблять осторожно, так как может быть токсичным.
Таким образом, вода и спирт обладают различными свойствами, что определяет их способность смешиваться между собой и их функциональное использование в различных областях.
Плотность
Вода и спирт имеют различную плотность, что приводит к их разделению при смешивании. Вода имеет плотность около 1 г/см³, тогда как плотность спирта составляет около 0,79 г/см³.
При добавлении спирта в воду, плотность смеси сначала уменьшается, поскольку спирт имеет меньшую плотность по сравнению с водой. Однако со временем происходит диффузия частиц, приводящая к равновесию плотности смеси. Это обусловлено тем, что молекулы спирта и воды перемешиваются и образуют гомогенную смесь.
Интересный факт: плотность спирта в воздухе тяжелее, чем плотность воды в воздухе, поэтому неправильное использование спиртовых напитков может вызвать перевернутую плотность, где спирт накапливается внизу и создает особую угрозу безопасности.
| Вещество | Плотность (г/см³) |
|---|---|
| Вода | 1 |
| Спирт | 0,79 |




