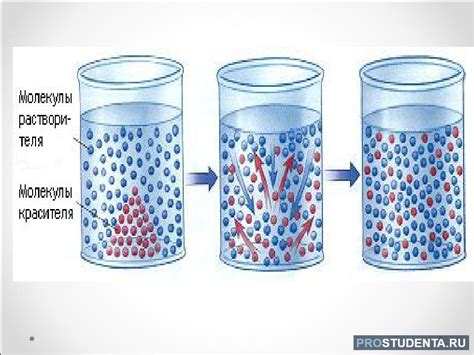
Диффузия - это процесс перемещения молекул вещества из области повышенной концентрации в область сниженной концентрации. В газах этот процесс происходит значительно быстрее, чем в жидкостях. Но почему же скорость диффузии в жидкостях меньше?
Одной из основных причин является различие в структуре газов и жидкостей. В газах молекулы находятся на достаточно больших расстояниях друг от друга и между ними действуют слабые притяжения. В результате, молекулы газов имеют большую свободу перемещения. В жидкостях же молекулы находятся ближе друг к другу и подвержены более сильным взаимодействиям, таким как взаимодействия Ван-дер-Ваальса и водородные связи. Эти силы затрудняют перемещение молекул и замедляют диффузию.
Кроме того, важную роль в скорости диффузии играют масса и размер молекул. Весомые молекулы в газах перемещаются медленнее по сравнению с легкими молекулами. В жидкостях масса и размер молекул существенно больше, что приводит к тому, что диффузия происходит еще медленнее.
Первый фактор: молекулярный размер
Молекулы в газе имеют значительно больший средний молекулярный размер, поскольку они находятся на большем расстоянии друг от друга и имеют свободную структуру. Это делает их более подвижными и способными к быстрым перемещениям.
В то время как жидкости имеют более плотную структуру (молекулы находятся ближе друг к другу), что приводит к более сильным взаимодействиям между ними. Такие взаимодействия снижают подвижность молекул и замедляют скорость диффузии.
Таким образом, молекулярный размер играет важную роль в различии скорости диффузии между газами и жидкостями, делая ее меньшей в последних.
Почему молекулярный размер важен?
Молекулы в газах обычно имеют маленький размер по сравнению с молекулами в жидкостях. Это означает, что молекулы газа легче проникают в промежутки между молекулами, поэтому они могут диффузировать быстрее.
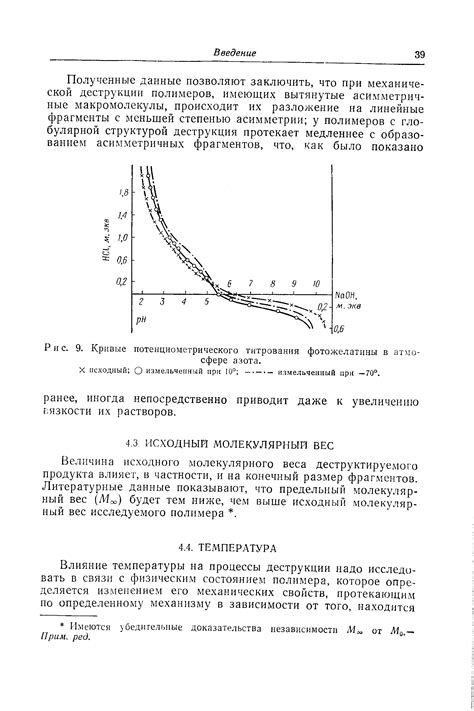
С другой стороны, молекулы в жидкостях находятся ближе друг к другу из-за сильных межмолекулярных взаимодействий. Молекулы в жидкости могут перемещаться только через промежутки между соседними молекулами, и молекулярный размер становится критическим фактором. Более крупные молекулы в жидкости будут испытывать большее сопротивление и будут диффундировать медленнее, так как им будет сложнее «проскользнуть» между молекулами.
Таким образом, молекулярный размер имеет существенное значение для скорости диффузии в жидкостях. Чем больше молекулярный размер, тем медленнее будет скорость диффузии. Это объясняет, почему диффузия в газах происходит быстрее, так как их молекулы обычно имеют меньший размер.
Диффузия в газах
Основными факторами, влияющими на скорость диффузии в газах, являются масса молекул и их средняя кинетическая энергия. Средняя кинетическая энергия газовых молекул зависит от их температуры. Поэтому при повышении температуры скорость диффузии также увеличивается.
Также важным фактором является концентрация газовых молекул. Чем выше концентрация газа, тем быстрее будет происходить диффузия.
Однако скорость диффузии в газах гораздо выше, чем в жидкостях. Это объясняется тем, что молекулы в газах находятся в более свободном состоянии и могут двигаться более дальними прыжками. В жидкостях молекулы находятся ближе друг к другу и двигаются меньшими прыжками, что снижает скорость диффузии.
Также следует отметить, что в газах существует более высокая вероятность столкновений молекул, что способствует более эффективной диффузии.
Понимание процесса диффузии в газах имеет важное значение не только в химии, но и в биологии, физике и других областях науки. Этот процесс играет ключевую роль в реакциях веществ и транспорте веществ через мембраны.
Второй фактор: межмолекулярные взаимодействия
Межмолекулярные взаимодействия, такие как ван-дер-ваальсовы силы и электростатические силы, существенно замедляют движение молекул и тем самым ограничивают скорость их диффузии. При перемещении в жидкости молекулы сталкиваются со смежными молекулами, что приводит к затратам энергии на преодоление взаимодействий между ними.
В отличие от этого, в газообразной среде межмолекулярные взаимодействия значительно слабее, так как расстояния между молекулами газа гораздо больше, а слабые молекулярные силы притяжения пренебрежимо малы. В результате, молекулы газа движутся свободно и без препятствий, что способствует более быстрой диффузии.
Почему межмолекулярные взаимодействия важны?

Межмолекулярные взаимодействия играют значительную роль в объяснении различных физических явлений и свойств веществ. Они влияют на различные аспекты поведения и свойства вещества, в том числе на скорость диффузии в жидкостях.
Межмолекулярные взаимодействия возникают между атомами, молекулами или их частями. Наиболее часто встречающимися видами межмолекулярных взаимодействий являются ван-дер-ваальсовы силы, дисперсионные взаимодействия, электростатические силы и водородные связи.
В случае газов, межмолекулярные силы обычно слабы, и молекулы свободно движутся и сталкиваются между собой. Это позволяет газам демонстрировать высокие значения диффузии, то есть быстро распространяться в пространстве. В жидкостях же существуют более сильные межмолекулярные взаимодействия, которые удерживают молекулы ближе друг к другу. В результате жидкость обладает более высокой вязкостью и более низкой скоростью диффузии по сравнению с газами.
Межмолекулярные взаимодействия также играют важную роль в образовании межфазных границ и поверхностных явлений, таких как капиллярные явления или смачивание поверхности. Они также влияют на различные физические свойства вещества, включая точку кипения, температуру плавления, плотность и теплоемкость.
Исследование межмолекулярных взаимодействий помогает лучше понять механизмы транспорта веществ и разработать новые материалы с определенными свойствами. Понимание и контроль межмолекулярных взаимодействий имеет важное значение в различных областях, включая фармацевтику, материаловедение, биологию и науку о пище.




