Химические реакции являются основой изучения химии в 11 классе. Это процессы, которые протекают при комбинировании различных веществ, в результате которых образуются новые вещества с измененными свойствами. Знание и понимание причин, по которым химические реакции протекают, является важным для понимания основных принципов химии и ее практического применения.
Основная причина протекания химических реакций в 11 классе - реакционная способность веществ. Каждое вещество обладает своими реакционными способностями, которые определяют его способность взаимодействовать с другими веществами. Эти способности могут быть связаны с наличием непарных электронов, возможностью передачи или приема электронов, наличием изменений в структуре молекулы и другими факторами.
Другой важной причиной протекания химических реакций является термодинамическая стабильность веществ. Некоторые вещества обладают высокой энергией и нестабильностью, что приводит к их стремлению к претерпеванию химических реакций для достижения более низкой энергетической составляющей. Такие реакции позволяют веществам достичь термодинамического равновесия и стабильного состояния.
В данной статье мы рассмотрим подробно причины и факторы, которые влияют на протекание химических реакций в 11 классе. Мы разберем основные законы и теории, которые описывают данные процессы, а также рассмотрим практические примеры их применения. Понимание и усвоение этих материалов поможет студентам углубить свои знания в химии и применять их на практике.
Основы химических реакций в 11 классе: презентация

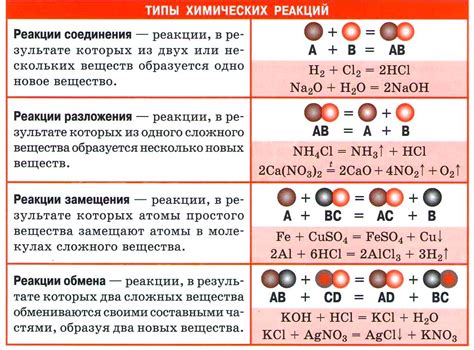
Основные типы химических реакций:
- Синтез (объединение веществ) - в результате реакции двух или более веществ образуется новое вещество.
- Анализ (разложение веществ) - в результате реакции одного вещества образуется два или более простых вещества.
- Замещение - атомы одного элемента замещают атомы другого элемента в соединении.
- Разделение - вещество расщепляется на две или более простых части.
Важные понятия в химических реакциях:
- Реагенты - вещества, которые участвуют в реакции.
- Продукты - вещества, которые образуются в результате реакции.
- Коэффициенты - числа, указывающие соотношение между реагентами и продуктами в сбалансированном уравнении реакции.
- Сбалансированное уравнение реакции - уравнение, где число атомов каждого элемента в реактивной части равно числу атомов каждого элемента в продуктовой части.
Протекание химической реакции зависит от нескольких факторов:
- Температура - повышение температуры может ускорить протекание реакции.
- Концентрация реагентов - увеличение концентрации повышает скорость реакции.
- Поверхность реагентов - чем больше поверхность контакта, тем быстрее протекает реакция.
- Катализаторы - вещества, которые ускоряют реакцию, не участвуя в ней.
Изучение химических реакций в 11 классе является важной частью программы по химии. Это помогает учащимся лучше понять принципы химии и применить их на практике.
Глава 1: Концепция химических реакций в 11 классе
Основной целью изучения химических реакций в 11 классе является понимание причин и условий, при которых происходят такие превращения веществ. Это позволяет ученикам анализировать различные химические процессы и прогнозировать их результаты.
В ходе изучения химических реакций в 11 классе ученики познакомятся с основными понятиями и законами химии, которые помогут им объяснить, почему происходят эти реакции.
Некоторые из основных концепций, которые будут рассматриваться в этой главе:
| 1. Реакции и вещества | – объяснение, каким образом вещества превращаются друг в друга в результате химических реакций. |
| 2. Реакционные условия | – рассмотрение температуры, давления и концентрации, как факторов, влияющих на протекание химических реакций. |
| 3. Реакционные скорости | – объяснение, почему некоторые реакции происходят быстро, а другие медленно, и как можно изменить скорость реакции. |
| 4. Химическое равновесие | – изучение состояния равновесия в химических реакциях и того, как его изменить. |
Для более глубокого понимания химических реакций в 11 классе, ученикам также предоставляются возможности для проведения лабораторных работ и экспериментов. Это позволяет им наблюдать и определять различные химические реакции на практике и проводить анализ их результатов.
Глава 2: Составляющие химических реакций в 11 классе

Химические реакции представляют собой процессы, в которых происходит изменение состава вещества.
В 11 классе химические реакции изучаются более подробно, и на этом этапе становится необходимым понимать и описывать их составляющие части.
Составляющими химической реакции являются реагенты и продукты. Реагенты - это вещества, которые воспринимают участие в реакции и исчезают после ее завершения. Продукты - это новые вещества, образовавшиеся в результате реакции.
Важным аспектом при изучении химических реакций является соблюдение закона сохранения массы, согласно которому масса реагентов должна быть равна массе продуктов.
Для более удобного представления и анализа реакций, они часто записывают в химической формуле. Химическая формула позволяет указать тип реакции, а также количество и соотношение веществ, причастных к реакции.
Также важно уметь интерпретировать химические уравнения. Они содержат информацию о количестве реагентов и продуктов, а также о количественных взаимосвязях между ними.
| Символ | Значение |
|---|---|
| A, B, C | Одноатомные элементы или простые соединения |
| X, Y, Z | Водород или любой элемент, образующий катионы |
| O | Кислород |
| H | Водород |
Изучив составляющие части химических реакций, можно проявить более глубокое понимание происходящих процессов и более эффективно применять полученные знания.
Глава 3: Факторы, влияющие на протекание химических реакций в 11 классе
1. Концентрация реагентов: Концентрация веществ, принимающих участие в реакции, оказывает прямое влияние на скорость и направление реакции. При повышении концентрации реагентов, скорость реакции увеличивается, так как количество веществ, готовых для реакции, увеличивается. Этот фактор часто иллюстрируется на примере химических реакций в растворах.
2. Температура системы: Температура также оказывает существенное влияние на скорость и характер реакции. Обычно, при повышении температуры, скорость химической реакции возрастает. При низкой температуре некоторые химические реакции могут вообще не протекать.
3. Поверхность соприкосновения: Площадь контакта между реагентами также может повлиять на скорость реакции. Чем больше площадь соприкосновения между веществами, тем быстрее протекает реакция. Этот фактор можно наблюдать, например, в реакциях горения, где раздробленное топливо горит быстрее, чем целые куски.
4. Катализаторы: Катализаторы - это вещества, которые ускоряют химическую реакцию, но при этом не участвуют в ней самой. Катализаторы снижают энергетический барьер реакции, делая ее более эффективной. Некоторые реакции могут быть подавлены без катализатора или не происходить вообще.
Важно отметить, что эти факторы не действуют сами по себе, а взаимодействуют вместе для определения скорости и экономичности реакции. Знание этих факторов помогает понять основные принципы протекания и контроля химических реакций в 11 классе.
Глава 4: Конкретные примеры химических реакций в 11 классе
В 11 классе ученики изучают множество различных химических реакций, которые играют важную роль в нашей повседневной жизни. В этом разделе мы рассмотрим некоторые конкретные примеры таких реакций.
| № | Химическая реакция | Описание |
|---|---|---|
| 1 | Синтез | Синтез – это процесс, при котором из двух или более простых веществ образуется одно более сложное вещество. Например, соединение азота и водорода приводит к образованию аммиака. |
| 2 | Анализ | Анализ – это процесс, при котором сложное вещество разлагается на более простые составляющие. Так, нагревание серной кислоты приводит к ее разложению на оксид серы и воду. |
| 3 | Окисление-восстановление | Окисление-восстановление – это реакция, при которой одно вещество окисляется, а другое вещество восстанавливается. Примером такой реакции является горение углеводородов (окисление) и дыхание (восстановление). |
| 4 | Кислотно-щелочная реакция | Кислотно-щелочная реакция – это реакция между кислотой и щелочью, при которой образуется соль и вода. Например, реакция между хлоридной кислотой и гидроксидом натрия приводит к образованию хлорида натрия и воды. |
Это только некоторые примеры химических реакций, которые изучаются в 11 классе. Изучение этих реакций помогает учащимся лучше понять принципы и законы химии, а также применять их на практике для решения реальных задач.




