Электрическая диссоциация в воде – важный физико-химический процесс, который играет ключевую роль во многих аспектах нашей жизни. Водный раствор является одним из наиболее распространенных и доступных систем, где происходит диссоциация. Открытие этого явления в XIX веке привело к революционным открытиям в химии и стало отправной точкой для развития многих технологий, применяемых в настоящее время.
Причина электрической диссоциации в воде заключается в особенностях структуры молекулы воды и ее полярности. Вода является полярным растворителем, что означает, что она имеет некоторый заряд на своей поверхности. Это связано с различной электроотрицательностью атомов кислорода и водорода, из которых состоит молекула. Молекула воды характеризуется небольшим разделением зарядов, где кислород имеет отрицательный заряд, а водород – положительный.
Когда в воду добавляются ионные вещества, такие как соли или кислоты, молекулы воды взаимодействуют с ионами. Полярность молекулы воды позволяет ей притягивать ионы, образуя вокруг них оболочку из обратно-ориентированных молекул воды, называемую гидратной оболочкой. Это уменьшает силу притяжения ионов друг к другу и приводит к их растворению в воде.
Роль воды в электрической диссоциации
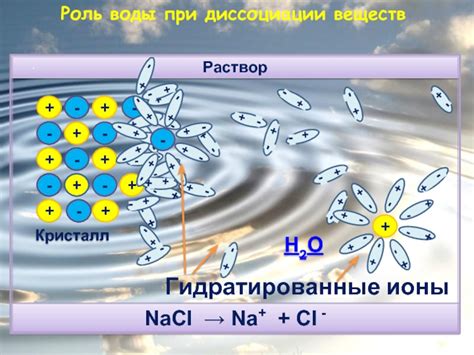
Вода может эффективно диссоциировать электролиты, так как ее молекулы обладают полярностью. Кислоты и основания, а также соли, диссоциируют в воде на ионы, которые предоставляют поверхность для электрических взаимодействий. Например, вода может диссоциировать хлорид натрия (NaCl) на ионы натрия (Na+) и хлорида (Cl-).
Электрическая диссоциация в воде происходит благодаря водородным связям, которые формируются между молекулами воды. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Каждый атом водорода образует ковалентную связь с кислородным атомом одной молекулы воды и слабую водородную связь с кислородным атомом соседней молекулы воды. Это позволяет электрическим зарядам легко перемещаться между молекулами воды.
Вода также обладает высокой диэлектрической проницаемостью, что способствует электрической диссоциации. Диэлектрическая проницаемость воды обусловлена ее способностью эффективно ориентировать ионные заряды, создавая поле, которое удерживает ионы в растворе.
В результате гидрофильной природы воды и ее способности диссоциировать электролиты, электрическая диссоциация становится возможной и играет важную роль во многих биологических и химических процессах.
Структура молекулы воды
Молекула воды (H2O) состоит из двух водородных атомов и одного атома кислорода, соединенных ковалентными связями. Атомы кислорода и водорода имеют разные электроотрицательности, что приводит к тому, что электроны в молекуле воды располагаются неодинаково.
Таким образом, электроны больше времени проводят около атома кислорода, образуя так называемый отрицательный конец молекулы воды, в то время как водородные атомы образуют положительный конец.
Из-за этой особенности структуры, молекулы воды могут образовывать водородные связи. Водородные связи - это слабые электростатические силы, которые возникают между атомами водорода одной молекулы и атомами кислорода или азота другой молекулы. Водородные связи являются более сильными, чем обычные ковалентные связи, и влияют на многие свойства воды, такие как ее высокая теплота парообразования и способность растворять большинство полюсных веществ.
Структура молекулы воды также позволяет ей образовывать кластеры или клатраты. Кластеры - это группы молекул воды, связанных вместе через водородные связи. Клатраты - это структуры, в которых молекула одного вещества находится внутри каверны или полости, образованной молекулами воды. Примером клатрата является гидратный мир, в котором молекула газа находится внутри структуры воды.
Структура молекулы воды играет ключевую роль в электрической диссоциации воды. Электростатическое взаимодействие между положительно и отрицательно заряженными концами молекул воды позволяет молекулам расщепиться на ионы - положительно заряженные ионы водорода (H+) и отрицательно заряженные ионы гидроксида (OH-). Таким образом, структура молекулы воды является важным фактором, определяющим возможность электрического разложения воды.
Водородные связи в воде
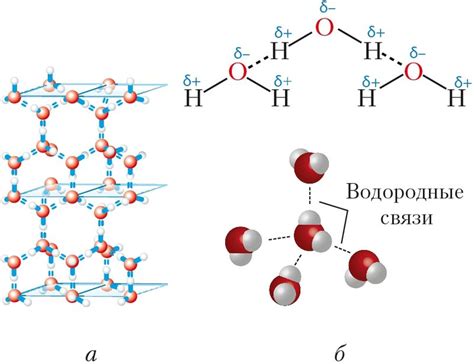
Одна из главных причин, по которой электрическая диссоциация происходит в воде, связана с формированием водородных связей. Водородные связи возникают, когда положительно заряженный водородный атом одной водной молекулы притягивается к отрицательно заряженному атому кислорода соседней молекулы воды.
Водородные связи в воде являются очень сильными и стабильными, их энергия составляет около 20-30 кДж/моль. Это значительно больше энергии обычных химических связей, что делает воду уникальным растворителем и средой для различных химических реакций.
Водородные связи в воде также обеспечивают ей свойства, которые являются ключевыми для жизни. Например, благодаря этим связям вода обладает высокой точкой кипения и плотностью в твердом состоянии. Это позволяет ей существовать в жидкой форме при широком диапазоне температур, обеспечивая поддержание жизни в океанах, реках и озерах. Кроме того, водородные связи позволяют молекулам воды образовывать тесно связанные структуры, которые обладают высокой поверхностной тензией и способствуют впитыванию и передвижению веществ в растениях и животных организмах.
Таким образом, водородные связи в воде играют важную роль в поддержании ее уникальных свойств и возможности электрической диссоциации, что делает воду основой для жизни на Земле.
Полярность молекулы воды
Данное распределение зарядов приводит к тому, что в молекуле воды возникает дипольный момент. То есть, молекула воды обладает положительной и отрицательной зарядами, которые создают электрическую полярность.
Полярность молекулы воды вызывает сильное притяжение между частицами вещества. Это притяжение позволяет молекулам воды протекать процессу диссоциации, т.е. распадаться на ионы положительного и отрицательного зарядов.
Таблица ниже демонстрирует полярность молекулы воды и распределение зарядов:
| Атомы | Заряд |
|---|---|
| Оксиген (O) | Отрицательный (-) |
| Водород (H) | Положительный (+) |
| Водород (H) | Положительный (+) |
Влияние полярности на электрическую диссоциацию
Электрическая диссоциация, или способность вещества разлагаться на ионы при взаимодействии с водой, играет важную роль в химических реакциях и реакциях растворения. Этот процесс особенно примечателен в случае воды, и это связано с поларностью молекулы H2O.
Вода является полярным растворителем, что означает, что она имеет разделение зарядов внутри молекулы. Кислородный атом воды притягивает электроны сильнее, чем водородные атомы, что приводит к разделению зарядов в молекуле. Кислородный атом становится частично отрицательно заряженным, а водородные атомы - частично положительно заряженными.
Из-за этой полярной природы воды, электрическая диссоциация происходит легче и быстрее. Полярность молекулы H2O позволяет притягивать ионы других веществ, что способствует их разделению и образованию раствора. Диссоциированные ионы имеют свои собственные заряды и могут взаимодействовать с другими веществами в растворе, образуя химические реакции и новые соединения.
Кроме того, полярность воды также повышает растворимость различных веществ, так как полярные соединения могут легче взаимодействовать с полюсами молекулы H2O и быть окруженными ею. Это объясняет, почему многие ионы растворяются в воде лучше, чем в неполярных растворителях.
| Полярные соединения | Неполярные соединения |
|---|---|
| NaCl (хлорид натрия) | Бензол |
| HCl (соляная кислота) | Масло |
| CH3OH (метанол) | Гексан |
Все эти факторы объединяются для обеспечения эффективной диссоциации в воде и обладают значительным влиянием на множество химических реакций и процессов, происходящих в водных растворах.
Процесс ионизации в воде
Процесс ионизации воды может быть представлен следующей реакцией:
| H2O(l) | → | H3O+(aq) + OH-(aq) |
В этой реакции молекула воды (H2O) превращается в гидрониевый ион (H3O+) и гидроксидный ион (OH-). Гидрониевые ионы являются положительно заряженными, а гидроксидные ионы – отрицательно заряженными.
Процесс ионизации воды очень важен для многих биологических и химических реакций, так как ионы, образующиеся в результате этого процесса, обладают свойствами, которые необходимы для проведения этих реакций.
Ионизация воды может быть усиленной при наличии солей или кислот. Кислоты могут донорировать протоны (H+) и тем самым способствовать образованию гидрониевых ионов. Процесс ионизации воды является фундаментальным процессом в химии и имеет огромное значение для понимания множества физико-химических явлений в природе.
Гидратация ионов в воде
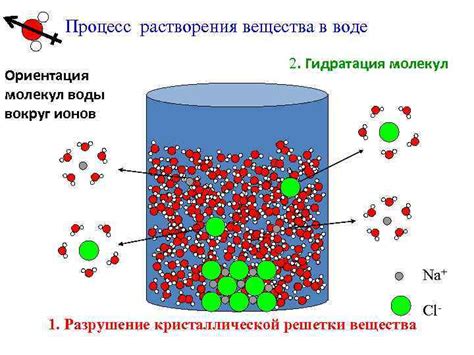
Гидратация ионов в воде играет важную роль в процессе электрической диссоциации. Когда ион растворяется в воде, молекулы воды окружают его, образуя гидратную оболочку, которая помогает разделить ионы и обеспечивает устойчивость их заряженным состояниям.
Гидратация ионов тесно связана с проводимостью электролитов. Полученные гидратные оболочки водородных связей позволяют ионам легко перемещаться в растворе, что помогает эффективной проводимости электрического тока. Гидратация ионов также может влиять на скорость химических реакций, где ионы играют роль реагентов или катализаторов.
Таким образом, гидратация ионов в воде является важным фактором, влияющим на многие химические и физические свойства растворов и способствующим электрической диссоциации ионов.
Роль температуры в электрической диссоциации
При повышении температуры происходит увеличение кинетической энергии молекул и усиление их движения. Плотность движения молекул увеличивается, что способствует нарушению связей между атомами в молекуле. Это облегчает процесс электрической диссоциации и позволяет большему количеству молекул распасться на ионы.
Однако, существуют исключения, когда повышение температуры может привести к уменьшению степени диссоциации. Например, для некоторых электролитов изменение температуры может изменить силу связи между ионами, что затрудняет процесс их разделения. Также, для некоторых реакций диссоциации тепло поглощается или выделяется, что необходимо учитывать при изменении температуры раствора.
Температура также может влиять на равновесие в системе. По принципу Ле Шателье повышение температуры, в общем случае, сдвигает равновесие реакции в сторону образования ионов и увеличивает степень диссоциации. Это связано с изменением константы равновесия и термодинамическими эффектами.
Важно отметить, что температура влияет не только на электрическую диссоциацию, но и на другие химические процессы в растворе. Таким образом, понимание взаимосвязи между температурой и электрической диссоциацией имеет большое значение в химии и физике растворов.
Практическое применение электрической диссоциации в воде

Электрическая диссоциация в воде имеет широкое практическое применение в различных отраслях науки и промышленности. Рассмотрим некоторые из них:
- Электролиз воды: Электролиз воды - это процесс разложения воды на кислород и водород под действием электрического тока. Этот процесс является основой для получения водорода, который затем может использоваться в производстве аммиака, металлов, а также в водородных топливных элементах.
- Анализ веществ: Электрическая диссоциация в воде позволяет проводить анализ различных веществ, используя методы электролиза, электрохроматографии и электродиализа. Такой анализ может быть полезен в медицине, пищевой промышленности, а также в экологических исследованиях.
- Синтез химических соединений: Электрическая диссоциация в воде играет важную роль в синтезе различных химических соединений. Например, при использовании электролиза можно получить хлор, которым затем можно производить множество химических продуктов. Кроме того, электрическая диссоциация в воде позволяет проводить электрохимические реакции, которые могут быть использованы для получения различных веществ.
- Улучшение проводимости: Электрическая диссоциация в воде позволяет повысить проводимость растворов различных веществ. Это используется в процессе электроосаждения металлов, проведения электроанализа, а также в процессе работы аккумуляторов и гальванических элементов.
- Очистка воды: Электрическая диссоциация в воде используется для очистки воды от различных загрязнений. Например, метод электрофлотации позволяет удалить взвешенные частицы и микроорганизмы из воды. Кроме того, электрохимические методы очистки воды могут быть использованы для удаления определенных веществ, таких как тяжелые металлы.
Видно, что электрическая диссоциация в воде имеет огромный практический потенциал и находит применение в различных областях. Постоянное развитие и эксперименты в этой области позволяют использовать этот процесс для получения новых материалов, развития новых методов анализа и очистки воды, а также для улучшения производственных процессов и создания более эффективных электронных устройств.




