Атомарные спектры – это явление, которое было открыто еще в 19 веке. Основной вклад в изучение атомных спектров внесли Густав Кирхгоф и Роберт Бюнзен. Они провели ряд экспериментов и выяснили, что при нагревании вещества его атомы испускают свет различных цветов.
Чтобы понять, почему атомарные спектры линейчатые, необходимо разобраться в устройстве атома. Классическая модель атома представляет собой простую систему, состоящую из ядра, вокруг которого вращаются электроны на определенных орбитах. Каждая орбита соответствует определенному энергетическому уровню, и переход электрона с одной орбиты на другую сопровождается испусканием энергии в виде фотона.
Один из основных принципов, лежащих в основе атомарных спектров, - это квантование энергии. Каждый энергетический уровень атома может принимать только определенные значения энергии. Когда электрон переходит с одного уровня на другой, возникает фотон с энергией, соответствующей разности энергетических уровней.
Атомарные спектры и их особенности
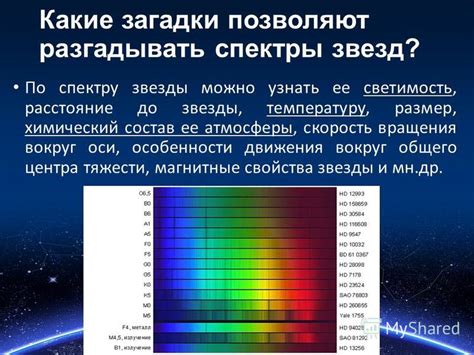
Атомарные спектры представляют собой уникальные линейчатые спектры, характерные для каждого химического элемента. Они возникают при излучении или поглощении электромагнитного излучения атомами в результате перехода их электронов между энергетическими уровнями.
Каждый атом имеет свою уникальную структуру энергетических уровней, представленных энергиями электронов вокруг атомного ядра. Переход электрона с одного энергетического уровня на другой сопровождается испусканием или поглощением энергии в виде электромагнитного излучения.
Спектры состоят из узких линий различной интенсивности, каждая из которых соответствует определенному переходу между энергетическими уровнями атома. Частота или длина волны каждой линии спектра связана с разницей энергий между уровнями и определяется формулой Ридберга.
Основной особенностью атомарных спектров является линейчатость - наличие узких линий спектра вместо непрерывного сплошного спектра. Это связано с квантовыми свойствами электрона и его возможностью находиться только на определенных энергетических уровнях. Когда электрон переходит с одного уровня на другой, излучается фотон с определенной энергией, что приводит к образованию линейчатого спектра.
Использование атомарных спектров позволяет идентифицировать элементы вещества и изучать их свойства. Они широко применяются в астрономии, спектральном анализе и других областях науки. Атомарные спектры играют важную роль в разработке новых материалов, технологий и устройств, а также позволяют получать информацию о составе и структуре атомов.
Таким образом, атомарные спектры представляют собой уникальный инструмент для изучения и понимания строения и свойств атомов, а их линейчатые особенности связаны с квантовой природой электрона и его энергетическими переходами.
Линейчатые спектры: причина и проявление
Линейчатые спектры представляют собой особый тип атомных спектров, характеризующийся дискретностью и наличием ярких узких линий. Почему спектры атомов имеют именно такой вид?
В основе линейчатых спектров лежит явление дискретного излучения энергии атомами. Энергетические уровни в атоме квантованы, и переход электрона с одного уровня на другой сопровождается излучением или поглощением энергии в виде электромагнитных волн.
При переходе электрона с одного энергетического уровня на другой происходит испускание кванта энергии в виде фотона. Энергия фотона связана с разностью энергий между уровнями. Разность энергий переходов в атоме определяет спектральные линии, которые наблюдаются при измерении.
При переходе вещества из возбужденного состояния в основное либо восстановление нормального состояния между атомами и их прочими электронами, происходят переходы щели-иони низшего состояния энергии. Эти переходы фиксируется спектральным анализатором и возможно установить возможное содержание ионов в процентах по критерию углового радиуса упорядоченности спектральных линий. Чем ближе к.единице радиус возможности положительного упорядочения, тем выше концентрация в этом компоненты.
Таким образом, линейчатые спектры атомов свидетельствуют о дискретном и квантовом характере энергетических состояний электронов в атоме. Изучение линейчатых спектров позволяет определить энергетическую структуру атомов и молекул, а также провести анализ химического состава вещества.
Что такое атомарные спектры?
Каждая линия в атомарном спектре соответствует определенному энергетическому переходу, который должен быть дискретным. Это означает, что энергия электрона может иметь только определенные значения, а не непрерывный спектр значений, как, например, энергия свободных частиц.
Такие дискретные значения энергии возникают из-за квантовой природы электрона, где его энергетические уровни описываются квантовыми числами. Переходы между этими энергетическими уровнями приводят к излучению или поглощению энергии в виде фотонов света с определенными частотами, что и создает линейчатый вид атомарных спектров.
Атомарные спектры являются важным инструментом для изучения электронной структуры атомов и молекул. Из них можно определить энергетические уровни и энергию переходов между ними, а также провести качественную и количественную аналитику различных веществ на основе их уникальных спектральных линий.
Спектральные анализаторы, основанные на атомарных спектрах, широко используются в физике, астрономии, химии, спектроскопии и других научных исследованиях. Они позволяют определять состав веществ, изучать их свойства, а также получать информацию о процессах, происходящих на атомном и молекулярном уровнях.
Влияние электронных оболочек на спектры
Когда электрон находится в атоме, он может находиться на определенном энергетическом уровне. Каждый энергетический уровень отвечает определенному состоянию электрона, и переход между этими состояниями приводит к излучению или поглощению энергии в виде электромагнитного излучения.
Влияние электронных оболочек на спектры проявляется в том, что каждая оболочка содержит несколько подуровней энергии, которые соответствуют различным значениям момента. Переходы между этими подуровнями вызывают появление спектральных линий на спектре атома.
Таким образом, линейчатость атомных спектров обусловлена специфической структурой электронных оболочек атомов и возможностью электронов переходить между различными энергетическими уровнями. Каждый переход вызывает появление линии на спектре, что и обусловливает линейчатость спектра атома.
Каковы основные типы атомарных спектров?
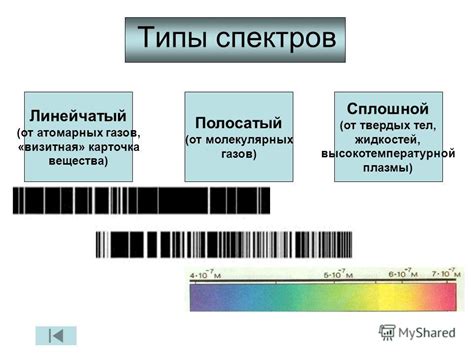
Атомарные спектры можно разделить на три основных типа: линейчатые (линиевые), непрерывные и полосчатые.
Линейчатые спектры представляют собой набор отдельных узких линий на фоне темного фона. Каждая линия соответствует переходу электрона из одного энергетического уровня на другой в атоме или молекуле. Линейчатые спектры наблюдаются при поглощении или испускании энергии в видимой части спектра.
Непрерывные спектры представляют собой непрерывный набор цветов, от одного к другому без видимых разделительных линий. Они возникают в случае, когда электроны меняют свои энергетические уровни с практически любыми значениями, образуя непрерывный спектр значений энергии. Это наблюдается, например, при нагреве твердого вещества, где электроны переходят с нижних на более высокие энергетические уровни.
Полосчатые спектры являются промежуточным типом между линейчатыми и непрерывными спектрами. Они представляют собой набор широких полос или полосок, которые могут быть слегка разделены линиями. Полосчатые спектры наблюдаются при комбинации переходов электронов между энергетическими уровнями.
| Тип спектра | Описание |
|---|---|
| Линейчатые | Набор отдельных узких линий на фоне темного фона |
| Непрерывные | Непрерывный набор цветов, без видимых разделительных линий |
| Полосчатые | Набор широких полос или полосок с разделительными линиями |
Роль энергетических уровней в образовании спектров
Атомарные спектры, представленные в виде линейчатых линий на спектральных линиях, обладают особой важностью для изучения строения и свойств атомов. Однако, что обуславливает линейчатую структуру спектров?
Роль энергетических уровней атомов в формировании спектров объясняется квантовой механикой. Атом состоит из ядра и электронных оболочек, которые имеют определенные энергетические уровни. Каждый энергетический уровень соответствует определенной энергии электрона в атоме.
Когда атому сообщают энергию, например, за счет нагревания или воздействия электромагнитного излучения, электроны переходят на более высокие энергетические уровни. Это состояние атома называется возбужденным состоянием. Однако, электроны не могут находиться бесконечно долго на возбужденных уровнях и в результате они возвращаются на нижние, более стабильные энергетические уровни. При этом они испускают энергию в форме электромагнитных волн.
Излучение и поглощение электромагнитных волн происходит при переходе электронов между энергетическими уровнями атома. Каждый переход соответствует определенной длине волны, которая выражается в виде спектральной линии. Таким образом, линейчатая структура атомных спектров обусловлена разностью энергий между энергетическими уровнями электронов в атомах.
Изучение и анализ линейчатых спектров позволяет определить энергетическую структуру атома, его внутреннее строение, а также провести анализ вещества на составляющие элементы. Это особенно полезно в области астрофизики, химии и других областях науки, где требуется идентификация и изучение атомных и молекулярных систем.
Квантовая механика и атомарные спектры

В основе атомарных спектров лежит явление излучения и поглощения электромагнитного излучения атомами. Когда атом переходит из одного энергетического состояния в другое, то его электроны поглощают или испускают энергию в виде фотонов. Эти фотоны, имеющие определенную энергию, создают линии спектра, которые можно наблюдать с помощью спектральной аппаратуры.
Квантовая механика объясняет линейчатость атомарных спектров через квантовые числа, которые определяют разрешенные энергетические состояния электрона вокруг ядра атома. Каждому энергетическому состоянию соответствует определенная энергия и определенное значение орбитального момента электрона.
Атомарные спектры обладают линейчатостью, так как в квантовой механике предусматривается, что электрон может находиться только в определенных энергетических состояниях, являющихся квантовыми уровнями. Переход электрона между этими уровнями происходит с излучением или поглощением фотона определенной энергии.
Таким образом, линейчатость атомарных спектров является следствием квантовых ограничений, накладываемых на возможные значения энергии электрона в атоме. Изучение и анализ этих линий спектра позволяет ученым получать информацию об энергетических уровнях и свойствах атомов, исследуя их взаимодействие с излучением.
Применение атомарных спектров в науке и технологиях
Одним из главных применений атомарных спектров является анализ состава и структуры вещества. Путем изучения линий спектра, ученые могут определить, какие атомы или молекулы присутствуют в образце, а также их концентрацию. Это позволяет проводить анализ вещества на микроуровне, раскрывая его химический состав и помогая в исследовании различных материалов и веществ.
Кроме того, атомарные спектры находят применение в физике и астрономии. Исследуя спектральные линии звезд и галактик, астрономы могут получать информацию о составе и физических свойствах космических объектов. Это позволяет изучать эволюцию звезд, расстояния до звездных систем, и определить множество других характеристик Вселенной.
Атомарные спектры также находят применение в технологиях. Например, спектральные методы используются в аналитической химии, чтобы изучать состав материалов, включая лекарственные препараты, пищевые продукты, металлы и полупроводники. Атомарные спектры помогают контролировать качество продукции, определять примеси и обеспечивать безопасность в процессах производства.
Кроме того, атомарные спектры используются в спектроскопии, которая является основой различных методов исследования в области физики, химии, биологии и медицины. Спектроскопия позволяет изучать взаимодействие света и вещества, исследовать химические реакции, определять структуру молекул и многое другое.
| Область применения | Примеры |
|---|---|
| Астрономия | Исследование состава звезд и галактик |
| Аналитическая химия | Анализ состава материалов |
| Спектроскопия | Изучение взаимодействия света и вещества |




