Период - это одна из основных характеристик периодической таблицы Менделеева, которая помогает упорядочить и систематизировать химические элементы. В периодической таблице Менделеева элементы разделены на группы и периоды в зависимости от их атомных свойств и строения электронных оболочек.
Периодическая таблица состоит из семи периодов, которые соответствуют количеству энергетических уровней в атоме элемента. В каждом периоде находятся элементы с одинаковым количеством энергетических уровней. Начиная с первого периода, в котором находится только 2 элемента - водород и гелий, туда последовательно добавляются новые элементы с каждым следующим периодом.
Периоды в периодической таблице Менделеева также подчиняются закономерности: с левой стороны таблицы элементы имеют наименьшее число энергетических уровней и наибольшую электроотрицательность, а справа - наоборот. Следовательно, они различаются по своим химическим свойствам и реактивности. Кроме того, каждый следующий период начинается с элемента с новым энергетическим уровнем и новым набором электронов, что также влияет на их химические свойства.
Периодическая таблица Менделеева
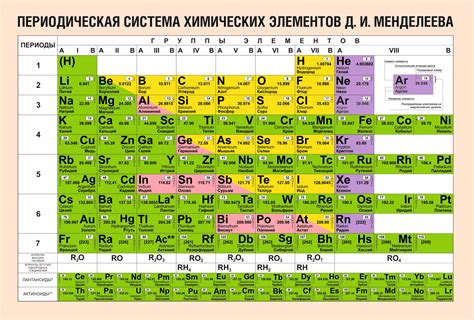
Таблица Менделеева состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами. Каждый период в таблице представляет новый энергетический уровень, на котором находятся электроны в атомах элементов этого периода. Всего в таблице Менделеева существует семь периодов.
Каждый новый период начинается с элемента, у которого заканчивается заполнение предыдущего периода. Это позволяет группировать элементы с похожими свойствами в одном периоде. Количество элементов в каждом периоде увеличивается с каждым новым периодом: первый период состоит из 2 элементов (водород и гелий), второй - из 8 элементов, третий - из 8 элементов и т.д.
Группы в таблице Менделеева представляют столбцы элементов, которые имеют сходные свойства и структуру внешних электронных оболочек. Номер каждой группы соответствует количеству электронов в внешней оболочке элементов этой группы. Всего в таблице Менделеева существует 18 групп.
Периодическая таблица Менделеева является незаменимым инструментом в научных исследованиях и практическом применении химических элементов. Она позволяет предсказывать химические свойства неизвестных элементов, а также облегчает поиск и анализ данных об известных элементах.
Структура таблицы
Периодическая таблица Менделеева представляет собой систематическое размещение химических элементов в виде таблицы, где элементы расположены в порядке возрастания атомных номеров.
Таблица состоит из строк, называемых периодами, и столбцов, называемых группами. Всего в таблице 7 периодов и 18 групп. Каждый элемент, находящийся в одной и той же строке, имеет одинаковое количество энергетических уровней электронов. Каждый столбец представляет собой группу элементов с аналогичной электронной конфигурацией, то есть содержащих одинаковое число электронов на внешнем энергетическом уровне.
Первый период состоит из 2 элементов: водорода (H) и гелия (He). Второй период содержит 8 элементов, третий - 8 элементов, и так далее. В последних периодах (с 6 до 7) содержится большее число элементов, поскольку энергетические уровни становятся все более заполненными.
Группы элементов расположены вертикально и имеют общие характеристики. Например, элементы группы IA (1) в основном образуют ионы с однозарядными катионами, а элементы группы VIIA (17) образуют ионы с однозарядными анионами. Элементы группы VIII (18), также известные как инертные газы или благородные газы, характеризуются стабильной электронной конфигурацией и низкой реактивностью.
Периоды в периодической таблице
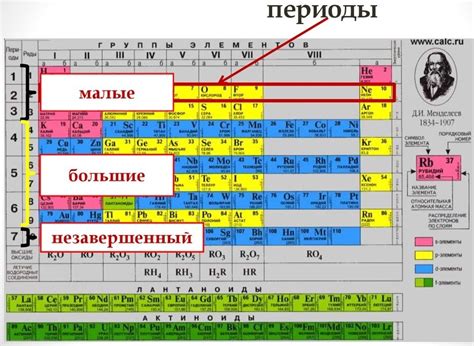
Периоды в периодической таблице Менделеева представляют собой горизонтальные строки, которые пронумерованы числами от 1 до 7. Каждый период соответствует новому энергетическому уровню электронной оболочки атома.
В периодической таблице периоды отделяются друг от друга горизонтальными линиями, что делает ее более понятной для чтения и анализа.
В каждом периоде количество элементов постепенно увеличивается. Например, в первом периоде находятся только два элемента - водород и гелий, во втором периоде - восемь элементов, в третьем - восемь, и так далее.
Периоды также играют важную роль в определении химических свойств элементов. Каждый период обычно характеризуется определенной химической реактивностью и свойствами, что позволяет установить закономерности в химических связях и реакциях.
Кроме того, периоды также помогают классифицировать элементы в периодической таблице и представляют порядок, в котором элементы расположены. Эта систематическая организация позволяет увидеть связи и зависимости между различными элементами и использовать эту информацию в научных и технологических исследованиях.
Разделение элементов по периодам
Периодическая таблица Менделеева представляет собой систематическое расположение химических элементов в виде таблицы, в которой элементы разделены на определенные горизонтальные ряды, называемые периодами. Всего в таблице существует 7 периодов.
Каждый период начинается с атома с самым низким атомным номером и постепенно увеличивается. Соответственно, периоды в таблице Менделеева отображают различные уровни энергии электронных оболочек атомов элементов.
Первый период включает только два элемента - водород (H) и гелий (He). Это объясняется тем, что у этих элементов всего одна электронная оболочка. У водорода она содержит один электрон, а у гелия - два.
Второй период содержит элементы от лития (Li) до неона (Ne), которые имеют две электронные оболочки. У лития оболочка состоит из двух электронов - одного на первой оболочке и одного на второй. У неона обе электронные оболочки полностью заполнены - на первой оболочке два электрона, а на второй - восемь.
Третий период объединяет элементы от натрия (Na) до аргона (Ar). Эти элементы имеют три электронные оболочки. Натрий имеет два электрона на первой оболочке, один на второй и ни одного на третьей. У аргона все три оболочки заполнены - на первой два электрона, на второй восемь, на третьей также восемь.
Четвертый период содержит элементы от калия (K) до криптона (Kr). У этих элементов число электронных оболочек также равно четырем. Калий имеет два электрона на первой оболочке, восемь на второй, восемь на третьей и один на четвертой. Криптон имеет два электрона на первой оболочке, восемь на второй, восемь на третьей и восемь на четвертой.
Пятый период включает элементы от рубидия (Rb) до ксенона (Xe). У них пять электронных оболочек. Рубидий имеет два электрона на первой оболочке, восемь на второй, восемь на третьей, одиннадцать на четвертой и два на пятой. Ксенон имеет два электрона на первой оболочке, восемь на второй, восемь на третьей, восемь на четвертой и восемь на пятой.
Шестой период включает элементы от цезия (Cs) до бария (Ba). У них шесть электронных оболочек. Цезий имеет два электрона на первой оболочке, восемь на второй, восемь на третьей, восемь на четвертой, восемь на пятой и одиннадцать на шестой. Барий имеет два электрона на первой оболочке, восемь на второй, восемь на третьей, восемь на четвертой, восемь на пятой и восемь на шестой.
Седьмой период включает элементы от франция (Fr) до оганессона (Og). У них семь электронных оболочек. Количество электронов на оболочках увеличивается с ростом атомного номера.
Таким образом, разделение элементов по периодам в периодической таблице Менделеева отражает особенности электронной структуры атомов и позволяет лучше понять их химические свойства и реактивность.
Свойства элементов в периодах
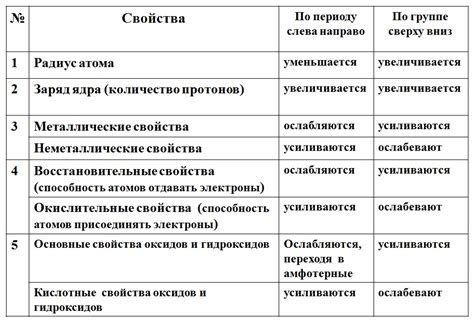
Внутри каждого периода происходит изменение электронной конфигурации элементов. Например, в первом периоде находятся элементы с одной электронной оболочкой (водород и гелий), во втором периоде - с двумя оболочками и т.д. Это влияет на химическую активность элементов и их способность образовывать химические связи.
Также, свойства элементов в периодах могут быть объяснены с помощью периодического закона. Согласно этому закону, свойства элементов изменяются периодически в зависимости от их атомного радиуса, электроотрицательности, ионизационной энергии, электронной аффинности и других характеристик.
Например, элементы первого периода (водород и гелий) обладают особыми свойствами. Водород - самый легкий элемент в таблице, образует воду и множество органических соединений. Гелий - инертный газ, химический элемент с наименьшей электроотрицательностью и наибольшим атомным радиусом.
Второй период характеризуется наличием элементов, образующих ковалентные соединения, такие как литий, бериллий, бор и др. Они имеют большую электроотрицательность и меньший атомный радиус по сравнению с элементами первого периода.
Таким образом, свойства элементов в периодах обусловлены их положением в таблице Менделеева, электронной конфигурацией и периодическим законом. Изучение этих свойств позволяет лучше понять химические свойства элементов и их роль в реакциях и процессах, происходящих в природе и промышленности.
Значение периодов для химии
Периоды в периодической таблице Менделеева играют важную роль в изучении и понимании свойств элементов и их химических реакций. Каждый период представляет собой горизонтальную строку в таблице, где расположены элементы с одинаковым количеством электронных оболочек.
Периоды позволяют нам легко определить основные химические свойства элементов в таблице. Например, в первом периоде находятся только два элемента - водород и гелий. Они оба имеют одну электронную оболочку и обладают схожими химическими свойствами.
С каждым новым периодом, количество электронных оболочек у элементов увеличивается на одну. Это приводит к изменению химических свойств элементов и возможности образования новых соединений.
Важным свойством периодов является постепенное изменение электронной конфигурации элементов. Так, в первом периоде электронная конфигурация элементов имеет общую форму 1s1 и 1s2. А во втором периоде уже есть элементы с электронной конфигурацией 2s1 и 2s2.
Периоды также позволяют нам определить тренды в свойствах элементов. Например, с увеличением номера периода, электроотрицательность элементов обычно увеличивается, а размеры атомов увеличиваются. Эти тренды позволяют нам предсказывать поведение элементов и прогнозировать их реакционную способность.
Практическое применение периодов

Одним из практических применений периодов является разработка новых легких материалов для авиационной и автомобильной промышленности. Некоторые элементы, такие как алюминий и магний, имеют низкую плотность и высокую прочность, что делает их идеальными для создания легких и прочных конструкций. Исследователи ищут способы комбинировать различные элементы из одного периода или различных периодов, чтобы создать новые материалы с улучшенными свойствами.
Периоды также помогают в понимании электронной структуры и свойств элементов. Это открывает возможности для создания новых сенсорных устройств, полупроводников и электроники. Например, полупроводники из группы элементов, расположенных в одном периоде, могут использоваться для создания транзисторов, которые являются основой современной электроники.
Кроме того, понимание периодов помогает в разработке новых лекарственных препаратов. Некоторые элементы, такие как золото и платина, могут использоваться как катализаторы для синтеза органических соединений. Это позволяет ученым создавать новые молекулы с заданными свойствами и создавать более эффективные лекарства.
| Практическое применение периодов |
|---|
| Разработка легких конструкций в авиационной и автомобильной промышленности |
| Создание новых сенсорных устройств и полупроводников |
| Разработка новых лекарственных препаратов и катализаторов |




