Ионная связь и ковалентная полярная связь - это два разных типа химических связей между атомами в молекулах. Они отличаются как по своей природе, так и по своим физическим и химическим свойствам.
Ионная связь образуется, когда один атом отдает электроны другому атому, в результате чего оба атома приобретают заряды. Один атом становится положительно заряженным и называется катионом, а другой – отрицательно заряженным и называется анионом. Заряженные атомы притягиваются друг к другу и образуют ионную связь.
Ковалентная полярная связь возникает, когда два атома делят пару электронов между собой, но деление электронов не равномерное. В результате один атом становится частично положительно заряженным, а другой – частично отрицательно заряженным. Такие частично заряженные атомы притягиваются друг к другу и образуют ковалентную полярную связь.
В ионной связи атомы сильно притягиваются друг к другу, так как образовавшиеся катион и анион имеют разные заряды и притягиваются электростатической силой. Ионная связь обычно образуется между металлическими и неметаллическими атомами и обладает высокой энергией связи. Это делает ионные соединения твердыми и хрупкими, с высокими температурами плавления и кипения.
Ионная связь: особенности и примеры

Важной характеристикой ионной связи является полный или частичный перенос электронов от металла к неметаллу. В результате образуются два иона с противоположными зарядами: катион – положительно заряженный ион, и анион – отрицательно заряженный ион.
Примеры соединений, образованных ионной связью, включают:
| Вещество | Формула |
|---|---|
| Натрий хлорид | NaCl |
| Кальций оксид | CaO |
| Магний фосфат | Mg3(PO4)2 |
В ионной связи электроны не могут свободно двигаться, поэтому ионы образуют кристаллическую решетку. Это объясняет высокие значения температуры плавления и кипения ионных соединений.
Ионная связь обладает такими особенностями, как хрупкость, ломкость и способность проводить электрический ток в растворе или в расплавленном состоянии. Ионы могут образовывать соли, кислоты и основания. Благодаря этим особенностям ионная связь широко применяется в различных областях, включая химическую промышленность, фармацевтику и электротехнику.
Ковалентная полярная связь: особенности и примеры
Ковалентная полярная связь образуется между атомами неметаллов, отличается от ионной связи тем, что электроны не передаются от одного атома к другому, а они общие для обоих атомов. При этом электроны проводимости валентной оболочки некоторое время проводят вблизи атомных ядер, а затем перемещаются к ядру соседнего атома. Такой перенос осуществляется за счет разности электроотрицательности атомов, потому ковалентная полярная связь часто встречается между атомами с разной электроотрицательностью.
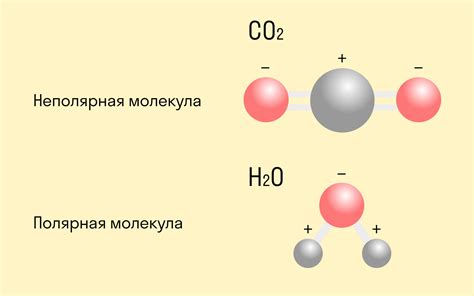
Примерами молекул, образованных ковалентной полярной связью, являются молекулы воды (H2O) и аммиака (NH3). В водной молекуле электроны проводимости перемещаются ближе к атому кислорода, что делает кислород частично отрицательно заряженным, а водород – частично положительно заряженным. В аммиаке электроны проводимости смещаются ближе к азоту, делая его отрицательно заряженным, а водород – положительно заряженным.
Различия между ионной связью и ковалентной полярной связью
1. Природа связи:
Ионная связь - это электростатическое притяжение между атомами, возникающее при передаче или приеме электронов. Один атом становится положительно заряженным, а другой - отрицательно заряженным. Ковалентная полярная связь - это связь, в которой электроны между атомами не равномерно распределены, что создает положительные и отрицательные частичные заряды.
2. Сила связи:
Ионная связь обычно сильнее, чем ковалентная полярная связь. Это связано с тем, что при ионной связи происходит полный перенос электронов от одного атома к другому, что приводит к образованию ионных кристаллических решеток с высокими энергиями связей. Ковалентная полярная связь формируется путем обмена электронной плотности между атомами, что приводит к более слабым связям.
3. Устойчивость связи:
Ионные связи обычно прочные и устойчивые, что делает соединения, содержащие ионные связи, твердыми и имеющими высокую температуру плавления и кипения. Ковалентные полярные связи обычно менее устойчивы, поэтому соединения, содержащие такие связи, могут быть в газообразном или жидком состоянии при комнатной температуре.
4. Полярность:
Ионные связи образуются между атомами с противоположными зарядами, что делает соединение полностью полярным. Ковалентные полярные связи образуются между атомами с неравномерным распределением электронной плотности, что делает соединение частично полярным.
5. Свойства веществ:
Ионные соединения обычно обладают хорошей проводимостью электрического тока в растворенном или расплавленном состоянии, но плохо проводят ток в твердом состоянии. Ковалентные соединения с полярной связью могут быть плохими проводниками электричества.




