Слабые электролиты – это вещества, в растворе которых наблюдается частичная диссоциация на ионы. Степень диссоциации слабого электролита является важной характеристикой этого процесса. От нее зависит количество ионов, образующихся в растворе, и степень их влияния на химическую и физическую активность системы.
Определение степени диссоциации слабого электролита является нетривиальной задачей, так как процесс диссоциации является равновесным. Однако, существует ряд факторов, влияющих на эту характеристику. Во-первых, степень диссоциации зависит от концентрации электролита в растворе. Чем больше концентрация, тем больше ионов образуется и тем выше степень диссоциации.
Кроме того, степень диссоциации слабого электролита зависит от его химического состава и структуры. Молекулы слабого электролита могут быть разнородными и иметь различные химические связи. Это влияет на вероятность диссоциации и образования ионов. Например, слабые кислоты могут иметь разные силы связи в молекуле, что влияет на их диссоциацию и степень диссоциации в растворе.
Молекулярное строение вещества
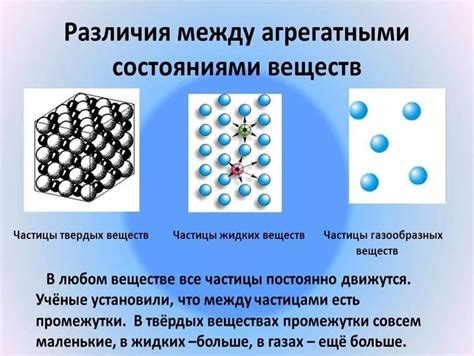
Некоторые слабые электролиты могут образовывать молекулы, состоящие из двух или более атомов, такие как диатомические молекулы, в которых два атома связаны химической связью. Другие слабые электролиты могут образовывать молекулы, состоящие из множества атомов, такие как полиатомные молекулы.
Молекулярное строение вещества определяет его свойства и поведение в растворе. Некоторые молекулы слабых электролитов могут подвергаться диссоциации, то есть разрушению связей внутри молекулы и образованию ионов, которые загружены электрическим зарядом. Это происходит только в условиях, когда вещество находится в растворе или водных растворах, так как влаги достаточно, чтобы нарушить связи между атомами в молекуле.
В зависимости от молекулярной структуры и других химических характеристик, степень диссоциации слабого электролита может варьировать. Некоторые слабые электролиты могут полностью диссоциировать в ионы, когда раствор делится на положительные и отрицательные ионы, образуя ионы гидрооксония (H3O+) и отрицательные ионы. Другие слабые электролиты могут только частично диссоциировать, и только некоторые молекулы разрушаются на ионы, а остальные остаются в молекулярной форме.
Общая степень диссоциации слабого электролита зависит от множества факторов, включая молекулярную структуру, концентрацию вещества, температуру и давление. Каждый из этих факторов может влиять на вероятность диссоциации молекулы и, следовательно, на степень ее диссоциации.
В целом, молекулярное строение вещества является важным фактором, который нужно учитывать при анализе степени диссоциации слабого электролита. Изучение молекулярного строения и его связи с физическими и химическими свойствами вещества может помочь более глубоко понять механизм диссоциации и его зависимость от различных параметров.
Концентрация раствора
Чем выше концентрация раствора слабого электролита, тем больше вероятность встретить в растворе ионизированные частицы. Это увеличивает вероятность их взаимодействия с другими частицами, что, в свою очередь, увеличивает степень диссоциации.
Однако, при достаточно высокой концентрации раствора, взаимное влияние ионов друг на друга начинает проявляться сильнее, что может приводить к обратному эффекту - уменьшению степени диссоциации. Это объясняется тем, что при высокой концентрации ионы начинают сильно мешать друг другу в перемещении, и слабый электролит может "выпадать" из раствора в виде осадка или не осуществлять полноценную диссоциацию.
Таким образом, концентрация раствора является важным фактором, непосредственно влияющим на степень диссоциации слабого электролита. Оптимальная концентрация раствора должна быть выбрана с учетом специфических свойств каждого слабого электролита.
Температура раствора
С увеличением температуры раствора молекулы электролита получают большую энергию, что способствует преодолению энергии активации и вызывает увеличение степени диссоциации. Более высокая температура повышает кинетическую энергию молекул, что приводит к увеличению столкновений между молекулами электролита и водной среды.
Также температура раствора может влиять на ионную мобильность в растворе. При повышении температуры ионы приобретают большую энергию и, следовательно, более легко двигаются в растворе. Это также способствует увеличению степени диссоциации.
Однако существуют случаи, когда повышение температуры может привести к уменьшению степени диссоциации. Например, некоторые слабые электролиты, такие как карбонаты и фосфаты, могут образовывать осадки при повышенных температурах, что снижает количество свободных ионов и, следовательно, степень диссоциации.
Таким образом, температура раствора оказывает комплексное влияние на степень диссоциации слабого электролита, и ее изменение может как увеличивать, так и уменьшать эту степень в зависимости от химических свойств и условий реакции.




