Основание - это химическое вещество, обладающее способностью принимать протон (H+) от кислоты и образовывать соль и воду. Основания играют важную роль в химических реакциях, а их свойства и применение представляют большой интерес для ученых и промышленности.
Применение оснований включает ряд областей, начиная от бытовых нужд до промышленности и науки. Самое известное применение оснований - в процессе нейтрализации кислот. Они используются для регулирования pH-уровня в воде и почве, а также в производстве мыла и моющих средств.
Основания обладают рядом свойств, которые делают их уникальными. Они могут быть растворимыми в воде или нерастворимыми, а также в зависимости от реакции с водой классифицируются как сильные или слабые основания. Сильные основания полностью диссоциируют в воде, образуя ионы гидроксида (OH-), в то время как слабые основания диссоциируются только частично.
Определение оснований в химии

Основания обладают определенными свойствами и характеристиками:
| Свойство | Описание |
|---|---|
| Протонный акцептор | Основания способны принимать протоны и образовывать соли. |
| Способность отдавать OH- | Основания могут отдавать ионы гидроксида (OH-) в растворе. |
| Нейтрализующая реакция с кислотами | Основания могут нейтрализовать кислоты путем принятия протонов от них и образования солей. |
Основания широко используются в различных областях химии и промышленности. Они находят применение в процессах нейтрализации, при производстве различных типов солей и растворов щелочей.
Известными примерами оснований являются гидроксиды, карбонаты и гидрокарбонаты металлов, аммиак и органические основания, такие как амины. Каждое из этих оснований имеет свои характеристики и особенности, которые определяют их реакционную способность и применимость в различных условиях.
Свойства оснований
Основания в химии обладают рядом характерных свойств, которые определяют их роль в химических реакциях.
Первое свойство оснований - алкаличность. Основания обладают способностью образовывать гидроксиды и протонироваться в водных растворах. Это позволяет им образовывать отрицательно заряженные ионы гидроксида, которые играют важную роль в реакциях нейтрализации и образовании солей.
Второе свойство оснований - способность образовывать ионы. Основания, взаимодействуя с водой, образуют гидроксидные ионы. Например, гидроксид натрия NaOH в водном растворе диссоциирует на ионы натрия (Na+) и гидроксидные ионы (OH-).
Третье свойство оснований - способность нейтрализовать кислоты. Основания и кислоты являются противоположными по своим свойствам веществами. Основания нейтрализуют кислоты, образуя соль и воду. Это происходит путем образования водородного связывания между ионами гидроксида и ионами водорода в кислотах.
И последнее свойство оснований, о котором стоит упомянуть, - электролитность. Основания в водном растворе ионизируются и образуют электролитически активные растворы. Это позволяет им проявлять свои химические свойства и участвовать в различных реакциях.
Физико-химические свойства оснований

Основания в химии обладают различными физико-химическими свойствами, которые определяют их поведение в различных условиях.
Одно из основных физико-химических свойств оснований - их способность образовывать ионный раствор в воде. Когда основание растворяется в воде, оно образует гидроксидные ионы (OH-), которые являются основной причиной алкалического действия оснований.
Другое важное свойство оснований - реакция с кислотами. Основания нейтрализуют кислоты, образуя соль и воду. Эта реакция особенно ярко проявляется при взаимодействии сильных оснований и сильных кислот. Нейтрализация кислоты основанием является ключевым процессом в химических реакциях, таких как образование солей и буферные реакции.
Основания также обладают способностью образовывать растворы с щелочной реакцией. Щелочные растворы, содержащие основания, обладают высоким показателем pH, большим 7. Это свойство оснований применяется в многих областях, таких как нейтрализация кислот, очистка воды и производство пищевых продуктов.
Физико-химические свойства оснований также включают их способность образовывать соли. При реакции с кислотами, основания образуют соль, в которой анионом выступает гидроксидная группа (OH-).
Некоторые основания обладают способностью адсорбировать влагу из окружающей среды. Это свойство называется гигроскопичностью. Это делает основания полезными в таких областях, как пищевая и фармацевтическая промышленность, где требуется контроль влажности.
В целом, физико-химические свойства оснований играют важную роль в химических реакциях и нашей повседневной жизни. Знание этих свойств позволяет более полно понять и использовать основания в различных сферах науки и технологии.
Щелочные и нейтральные основания
Щелочные основания, также известные как щелочи, обладают pH больше 7. Они характеризуются высокой концентрацией гидроксидных ионов (OH-) в растворе. Щелочные основания обладают щелочной реакцией и широко используются в промышленности, медицине и повседневной жизни.
Примерами щелочных оснований являются гидроксид натрия (NaOH), гидроксид калия (KOH) и аммиак (NH3).
Нейтральные основания имеют pH равный 7. Они не обладают сильной щелочной или кислотной функцией. Поэтому нейтральные основания наиболее близки к нейтральному pH и не вызывают реакций окисления или восстановления в растворе.
Примерами нейтральных оснований являются водные растворы нейтрального солей, таких как хлорид натрия (NaCl) и нитрат калия (KNO3).
| Тип основания | pH | Примеры |
|---|---|---|
| Щелочные основания | Больше 7 | Гидроксид натрия (NaOH), гидроксид калия (KOH), аммиак (NH3) |
| Нейтральные основания | 7 | Хлорид натрия (NaCl), нитрат калия (KNO3) |
Примеры применения оснований в химии
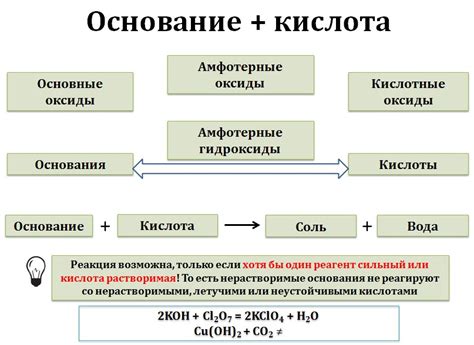
Основания играют важную роль во многих химических процессах и имеют широкое применение в различных областях. Вот несколько примеров использования оснований в химии:
- Нейтрализация кислот: основания используются для нейтрализации кислот и получения солей. Например, гидроксид натрия (NaOH) в реакции с соляной кислотой (HCl) дает хлорид натрия (NaCl) и воду (H2O).
- Процессы осаждения: во многих случаях основания применяются для осаждения металлов или металлокомплексов из растворов. Например, гидроксид аммония (NH4OH) используется для осаждения меди (Cu) из раствора медного сульфата.
- Стабилизация pH: основания используются для поддержания постоянного pH в различных химических процессах. Например, гидроксид аммония (NH4OH) используется в качестве буферного раствора для поддержания постоянного pH при проведении экспериментов в лаборатории.
- Производство мыла: в производстве мыла используются жирные кислоты и гидроксиды щелочных металлов, таких как гидроксид натрия (NaOH) или гидроксид калия (KOH). Процесс называется щелочной гидролизой жиров.
- Производство удобрений: основания используются в производстве удобрений, таких как аммиачная селитра или карбамид. Основания помогают восстанавливать pH почвы и обеспечивать необходимые условия для роста растений.
Реакции оснований с кислотами
Реакция между основанием и кислотой протекает по следующему уравнения:
NaOH + HCl → NaCl + H2O
В результате данной реакции образуются соль - хлорид натрия (NaCl) и вода (H2O). Кислота и основание попарно "обмениваются" ионами - положительные ионы H+ кислоты связываются с отрицательными ионами OH- основания, образуя молекулы воды.
Основания могут реагировать не только с соляной кислотой, но и с другими кислотами, например, серной (H2SO4), уксусной (CH3COOH) и многими другими.
Реакции оснований с кислотами широко используются в химической промышленности, медицине и пищевой промышленности для получения солей с нужными свойствами и удаления кислотных остатков.
Степень диссоциации оснований

Степень диссоциации основания зависит от условий реакции и свойств самого основания. Она может изменяться с изменением концентрации основания в растворе, температуры, присутствия других реагентов и pH-среды.
У оснований сильной степенью диссоциации (α близко к 1) все молекулы распадаются на ионы в растворе. Примером основания с высокой степенью диссоциации является гидрооксид натрия (NaOH), который полностью распадается на ионы натрия (Na+) и гидроксильные ионы (OH-) в водном растворе.
Основания с низкой степенью диссоциации (α близко к 0) распадаются на ионы в растворе с меньшей эффективностью или практически не распадаются. Примером основания со слабой степенью диссоциации является аммиак (NH3), который в водном растворе лишь частично распадается на ионы аммония (NH4+) и гидроксильные ионы (OH-).
Знание степени диссоциации основания позволяет определить его активность в растворе и прогнозировать химические реакции, в которых оно может участвовать. Изучение степени диссоциации оснований является важным аспектом химической кинетики и равновесия, а также имеет практическое значение в аналитической химии и других областях науки и техники.
Влияние pH на свойства оснований
Одним из ключевых факторов, влияющих на свойства оснований, является pH среды, в которой они находятся. pH, или концентрация водородных ионов, показывает, кислая или щелочная среда. Водные растворы оснований имеют pH значение выше 7, что свидетельствует о щелочной среде.
Влияние pH на свойства оснований состоит в следующем:
1. Степень диссоциации: pH среды оказывает влияние на степень диссоциации основания. В более кислотной среде, при низком pH, основания имеют низкую степень диссоциации. По мере повышения pH, степень диссоциации увеличивается, что позволяет основаниям лучше реагировать с кислотами.
2. Скорость реакции: pH также влияет на скорость реакции основания с кислотой. В более кислой среде реакция может идти медленнее, в то время как в более щелочной среде, при высоком pH, реакция может происходить быстрее.
3. Свойства растворов: Растворы оснований могут иметь различные свойства в зависимости от pH. Например, щелочные растворы оснований могут быть гладкими и вязкими, в то время как кислотные растворы оснований могут быть более густыми и пеными.
Понимание влияния pH на свойства оснований позволяет ученым и промышленным предприятиям эффективно использовать их для различных процессов. Это также позволяет более глубоко изучать их химические свойства и взаимодействия с другими соединениями.
Определение силы оснований в химии
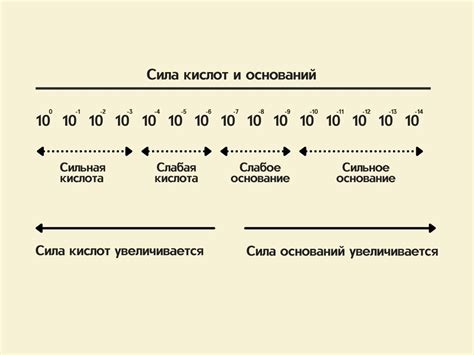
Сила оснований в химии связана с их способностью принимать протоны, образуя гидроксидные ионы (OH-) в растворе. Определение силы основания основано на его способности донорства электронной пары и на его химическом свойстве образовывать стабильные соединения.
Мощность основания зависит от его концентрации в растворе и от его ионизации. Более концентрированные основания иллюстрируют более сильные способности принимать протоны. Однако, концентрация основания - не единственный фактор, влияющий на его силу.
Основания могут быть классифицированы как сильные и слабые в зависимости от степени ионизации (диссоциации) в растворе. Сильные основания полностью диссоциируют в ионы OH- при определенных условиях и имеют высокую проводимость в растворе. Слабые основания, напротив, диссоциируют только частично и имеют низкую проводимость в растворе.
Силу основания можно также оценить с помощью pKb (отрицательный логарифм константы основания). Чем меньше значение pKb, тем сильнее основание.
- Сильные основания: гидроксиды щелочных металлов (NaOH, KOH), гидроксид аммония (NH4OH).
- Слабые основания: аммиак (NH3), гидроксид магния (Mg(OH)2), гидроксид алюминия (Al(OH)3).
Сила оснований играет важную роль во многих химических реакциях, включая нейтрализацию кислот и образование солей. Знание силы оснований помогает прогнозировать химические реакции, понимать их механизмы и выбирать наиболее подходящие условия для проведения экспериментов.
Защита кожи от щелочных оснований
Вот несколько полезных советов, которые помогут вам защитить кожу от щелочных оснований:
- Всегда носите защитные перчатки при работе с химическими веществами, особенно если они содержат щелочные основания. Это поможет предотвратить прямой контакт вещества с кожей.
- Избегайте длительного воздействия оснований на кожу. Если возможно, ограничьте время контакта и сразу промойте кожу теплой водой и мылом после работы с химическими веществами.
- Используйте специальные кремы и лосьоны, которые могут создать защитный барьер на поверхности кожи. Это поможет предотвратить проникновение щелочных оснований в глубокие слои кожи.
- Если случайно произошло попадание щелочного основания на кожу, немедленно промойте эту область большим количеством воды. При необходимости обратитесь за медицинской помощью.
Защита кожи от щелочных оснований является особенно важной для людей, работающих в лабораториях, производственных предприятиях и других местах, где возможен контакт с химическими веществами. Помните, что забота о безопасности кожи должна быть приоритетной задачей.




