Оксиды и гидроксиды являются важными классами химических соединений, которые широко распространены в природе и имеют многочисленные применения в промышленности. Изучение этих соединений позволяет понять многие аспекты химической реакции и их влияние на физические и химические свойства вещества.
Оксиды - это химические соединения, состоящие из атома кислорода и другого элемента. Они обладают высокой реакционной способностью и широко используются в процессах окисления и восстановления. Оксиды могут быть металлическими и неметаллическими, что дает им разные физические и химические свойства. Некоторые оксиды демонстрируют кислотные свойства, реагируя с водой и образуя кислоты.
Гидроксиды - это соединения, состоящие из иона гидроксила (OH-) и металла или аммония. Они характеризуются щелочными свойствами и обладают высокой растворимостью в воде. Гидроксиды могут быть использованы для регулирования pH в водных растворах и служить важными компонентами в процессах нейтрализации и осаждения.
Оксиды и гидроксиды играют важную роль в жизни на Земле. Они присутствуют в почве, воздухе и воде, и оказывают значительное влияние на среду и биологические системы. Изучение их свойств и взаимодействия с окружающей средой помогает разработать методы защиты окружающей среды и улучшить промышленные процессы.
Оксиды и гидроксиды: основные характеристики и свойства

Гидроксиды - это соединения, состоящие из группы гидроксильных ионов (OH-) и металлов или положительно заряженных радикалов. Гидроксиды обычно присутствуют в виде гидратов, то есть молекулы гидроксида связаны с молекулами воды. Их обычно используют как основные источники гидроксильных ионов.
Одной из основных характеристик оксидов и гидроксидов является их реакционная способность. Оксиды могут проявлять как кислотные, так и щелочные свойства в зависимости от соотношения элементов в соединении. Гидроксиды, в свою очередь, являются основными соединениями и обладают щелочными свойствами.
Свойства оксидов и гидроксидов также определяют их широкое применение в различных областях. Гидроксиды, например, часто используются в качестве щелочей при производстве мыла, очистке воды и регулировании кислотности. Оксиды же имеют широкое применение в производстве стекла, керамики, красителей и других химических продуктов.
Таким образом, оксиды и гидроксиды являются важными классами химических соединений, обладающих различными характеристиками и свойствами. Их знание и понимание помогает более полно разграничить их роль в химии и их применение в различных отраслях промышленности.
Что такое оксиды и гидроксиды
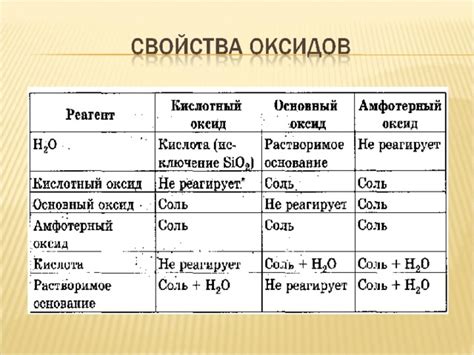
Оксиды - это химические соединения, состоящие из кислорода и других элементов. Они обычно образуются при окислительных реакциях, когда элементы связываются с кислородом. Оксиды могут быть кислыми, щелочными или нейтральными. Кислые оксиды образуют кислоты при взаимодействии с водой, щелочные оксиды образуют основания или гидроксиды, а нейтральные оксиды не проявляют химической активности.
Гидроксиды - это химические соединения, которые образуются в результате взаимодействия элементов с гидроксильной группой (-OH). Гидроксиды обычно обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Они также могут быть использованы как основные строительные блоки для создания других соединений.
Оксиды и гидроксиды играют важную роль в химических реакциях и имеют широкий спектр применений. Они используются в различных отраслях промышленности, включая производство стекла, металлургию, катализ и производство лекарственных препаратов.
Состав и структура оксидов и гидроксидов

Гидроксиды - это соединения, в которых один или несколько атомов водорода замещены металлическими ионами. Гидроксиды имеют общую структуру, называемую структурой слоистой решетки. В структуре слоистой решетки ионы металла образуют слои, а между слоями находятся ионы гидроксила (OH). Примером гидроксида является гидроксид натрия (NaOH) или гидроксид кальция (Ca(OH)2).
Состав и структура оксидов и гидроксидов имеют большое значение для их свойств и использования. К примеру, оксиды обладают различными свойствами, такими как кислотность или щелочность, которые определяют их реактивность и возможные применения. Гидроксиды, в свою очередь, являются основаниями и широко используются в жизни, например, в процессе нейтрализации кислот или в производстве мыла.
Физические свойства
Оксиды и гидроксиды обладают различными физическими свойствами, которые определяются их химическим составом и структурой.
Зависимость физических свойств от состава выражается в том, что разные оксиды и гидроксиды могут иметь разные точки плавления и кипения, плотности и твердости. Например, гидроксид кальция имеет плотность 2,24 г/см³ и твердость 2,5 по шкале Мооса.
Однако, существуют и общие закономерности. Например, оксиды и гидроксиды обычно являются твердыми веществами при комнатной температуре и давлении.
С точки зрения растворимости, большинство оксидов и гидроксидов слаборастворимы в воде. При этом, в зависимости от их положительного или отрицательного заряда, они могут проявлять себя как кислотные или щелочные оксиды.
Также стоит отметить, что оксиды и гидроксиды могут обладать свойствами, такими как проводимость тепла и электричества. Некоторые из них могут выделять тепло при реакции с водой или кислородом.
- Точки плавления и кипения: различные для каждого оксида или гидроксида;
- Плотность: переменная величина для разных соединений;
- Твердость: различная для разных оксидов и гидроксидов;
- Состояние при комнатной температуре и давлении: обычно твердые вещества;
- Растворимость: слаборастворимы в воде;
- Проводимость тепла и электричества: различна в зависимости от состава и структуры вещества;
- Выделение тепла: возможно при реакции с водой или кислородом.
В целом, физические свойства оксидов и гидроксидов являются важными для понимания их химических и физических свойств, а также применения в различных областях науки и промышленности.
Химические свойства

Оксиды и гидроксиды проявляют различные химические свойства в зависимости от их состава и структуры.
Оксиды образуются при соединении элемента с кислородом. Они могут быть кислородными или неокисными. Кислородные оксиды являются основными компонентами кислот и, как правило, обладают кислотными свойствами. Например, углекислый газ (СО₂) растворяется в воде и образует угольную кислоту (H₂СO₃). Неокисные оксиды не образуют кислоты при растворении в воде и могут обладать основными свойствами, например, оксид натрия (Na₂O) образует гидроксид натрия (NaOH).
Гидроксиды - это соединения, которые образуются при растворении металлов в воде или при взаимодействии оксидов и воды. Они обладают щелочными свойствами и образуют гидроксидные ионы (OH⁻). Например, гидроксид натрия (NaOH) растворяется в воде и образует ионы натрия (Na⁺) и ионы гидроксида (OH⁻). Гидроксиды широко используются в промышленности, в медицине и в быту.
Оксиды и гидроксиды могут реагировать друг с другом, образуя соли. Например, оксид натрия (Na₂O) и гидроксид серной кислоты (H₂SO₄) реагируют сообразно уравнению:
Na₂O + H₂SO₄ → Na₂SO₄ + H₂O
В результате образуется соль натрия (Na₂SO₄) и вода (H₂O).
Изучение химических свойств оксидов и гидроксидов позволяет лучше понять их реакционную способность и применение в различных областях жизни.
Роль в природе
Оксиды и гидроксиды играют важную роль в природе и влияют на различные аспекты окружающей среды.
Оксиды являются частью земной коры и составляют значительную часть минералов. Некоторые из них, такие как оксид железа, оксид алюминия и оксид кремния, обнаруживаются в больших количествах и широко используются в промышленности.
Оксиды и гидроксиды также играют важную роль в процессах эрозии и взаимодействия воды и почвы. Они могут изменять кислотность почвы и воздействовать на ее плодородие. Гидроксиды металлов, такие как гидроксид алюминия и гидроксид железа, могут образовывать нелинейные кластеры, которые влияют на структуру почвы и способствуют ее удержанию влаги.
Гидроксиды также являются важной частью химического цикла воды. Они способствуют образованию осадков и могут обладать дезинфицирующими свойствами. Например, гидроксид кальция, известный как навозный креотон, широко применяется в сельском хозяйстве для обработки почвы.
Оксиды и гидроксиды также важны в биологических системах. Многие из них являются ключевыми компонентами клеточных структур и выполняют роль коферментов в метаболических реакциях. Например, ферригидроксиды играют важную роль в процессах дыхания у растений и животных.
Кроме того, гидроксиды металлов используются в процессах очистки воды и сточных вод. Они способны связывать и удалить различные загрязнители, такие как тяжелые металлы и органические вещества.
Таким образом, оксиды и гидроксиды играют не только основную роль в химии и промышленности, но и важную роль в природе, влияя на многие процессы и явления в окружающей среде.
Использование в промышленности

Оксиды и гидроксиды имеют широкое применение в промышленности благодаря своим уникальным характеристикам и свойствам.
Оксиды используются в различных отраслях:
- Оксиды металлов широко применяются в производстве стекла, керамики и красок, так как они обладают специальными оптическими свойствами и позволяют создавать разнообразные цвета и оттенки.
- Оксиды кремния используются в производстве полупроводников и солнечных батарей, а также в производстве стекловолокна и керамических материалов.
- Оксиды железа широко применяются в производстве стали, красок, магнитов и катализаторов.
Гидроксиды также нашли применение в различных отраслях:
- Гидроксид натрия (щелочь) используется в производстве мыла, стекла, бумаги и текстиля. Также его используют в пищевой промышленности для регулирования кислотности и как пищевую добавку.
- Гидроксид кальция (известь) применяется в строительной промышленности, в производстве железных руд и стекла, а также в сельском хозяйстве для улучшения почвы.
- Гидроксид алюминия используется в производстве стекла, керамики, металлургии и водоочистке.
Использование оксидов и гидроксидов в промышленности является одним из главных факторов их экономической значимости и привлекательности для производителей.
Влияние на окружающую среду
Оксиды и гидроксиды, как химические соединения, могут оказывать значительное влияние на окружающую среду. Это связано с их химическими свойствами, которые могут вызывать различные процессы и реакции.
Некоторые оксиды и гидроксиды могут быть токсичными и вызывать вредные последствия при попадании в окружающую среду. Например, сернистый гидроксид (SO2) может вызывать кислотные дожди, которые наносят ущерб растительности и загрязняют поверхностные воды.
Кроме того, некоторые оксиды и гидроксиды могут быть важными веществами в глобальном цикле веществ в окружающей среде. Например, оксид азота (NOx) является важным веществом в атмосфере и может участвовать в формировании озона, который влияет на климат и здоровье человека.
Оксиды и гидроксиды также могут влиять на качество воздуха, особенно в промышленных районах. Некоторые из них, такие как диоксид серы (SO2) и оксид азота (NOx), являются основными источниками загрязнения воздуха и могут вызывать заболевания дыхательных путей и другие проблемы со здоровьем.
Кроме этого, оксиды и гидроксиды могут взаимодействовать с водой и почвой, изменяя их кислотно-щелочной баланс. Это может иметь негативное влияние на растительность, животных и микроорганизмы, которые зависят от определенного pH окружающей среды.
Оксиды и гидроксиды в живых организмах
Одним из наиболее распространенных оксидов в живых организмах является кислородный оксид, известный как кислород. Кислород играет ключевую роль в процессе дыхания и окислительно-восстановительных реакций, которые происходят в клетках. Он не только обеспечивает энергией клетки, но и участвует в поддержании аэробного обмена веществ.
Гидроксиды встречаются в организмах в виде гидроксида кальция (Ca(OH)2) и гидроксида магния (Mg(OH)2), которые часто используются в качестве добавок к пище или лекарственных препаратах. Гидроксид кальция, например, используется для поддержания нормального pH в организме и укрепления костей.
Некоторые живые организмы, такие как растения, используют гидроксиды в качестве структурных материалов. Например, гидроксид кремния играет важную роль в формировании кремниевых оболочек у морских водорослей и диатомовых водорослей. Эти оболочки обеспечивают защиту клеткам и придают им определенную форму и прочность.
Известны случаи, когда оксиды и гидроксиды могут быть токсичными для живых организмов. Например, оксид азота (NO) может быть вредным воздушным загрязнением и вызывать проблемы с дыханием. Гидроксид алюминия (Al(OH)3), который используется в некоторых антиацидных препаратах, может вызывать побочные эффекты, такие как запоры и газы.
В целом, оксиды и гидроксиды играют важную роль в живых организмах, участвуя в множестве биологических процессов и обеспечивая необходимую поддержку для нормального функционирования организма.




