Необратимые реакции являются одним из основных понятий в химии. Они играют важную роль в понимании реакционных механизмов и химических превращений, которые происходят в природе и в лабораторных условиях. Необратимые реакции характеризуются тем, что они происходят в одном направлении и не могут обратно превратиться в исходные вещества.
Необратимость реакций обусловлена изменением энергетического состояния реагирующих веществ в процессе химической реакции. В некоторых случаях, энергетический барьер, который необходимо преодолеть для образования продуктов реакции, является таким высоким, что реакция происходит только в одном направлении.
Необратимые реакции широко применяются в различных областях химии, включая синтез новых соединений, производство химической продукции и разработку фармацевтических препаратов. Например, многие промышленные процессы, такие как производство пластика и нефтехимические процессы, основаны на необратимых реакциях.
Важно отметить, что необратимость реакции может быть также обусловлена наличием дополнительных факторов, таких как наличие катализаторов или специфических условий реакции. Эти факторы могут изменять скорость реакции и сделать ее более эффективной в одном направлении.
Необратимые реакции в химии: определение и особенности

Основной признак необратимых реакций – образование продуктов, которые являются газами, не растворяются в реакционной среде или выпадают в осадок и не реагируют дальше. Также необратимые реакции происходят в условиях высокой концентрации продуктов или в присутствии катализаторов.
Примером необратимой реакции является горение, когда при сжигании вещества окислителем источник тепла. Продукты горения, такие как углекислый газ и вода, образуются только в процессе сжигания и не могут обратно превратиться в реагенты.
Одной из особенностей необратимых реакций является неизбежность образования побочных продуктов или отходов, которые могут быть вредными или загрязняющими для окружающей среды. Поэтому организация эффективной очистки отходов является важным аспектом при работе с необратимыми реакциями.
| Примеры необратимых реакций | Продукты реакции |
|---|---|
| Сжигание топлива | Углекислый газ (CO2), вода (H2O) |
| Гидролиз соли | Кислота и основание |
| Реакция нейтрализации | Вода (H2O) |
Важно отметить, что необратимые реакции играют важную роль в множестве процессов, таких как производство энергии, синтез химических соединений, а также в биологических и экологических системах. Понимание особенностей необратимых реакций позволяет более эффективно использовать и контролировать эти процессы для достижения желаемых целей.
Принцип необратимых реакций
Необратимая реакция в химии происходит только в одном направлении и не может вернуться к исходным реагентам. Принцип необратимости основан на законе сохранения энергии и энтропии.
Основные принципы необратимых реакций:
- Необратимая химическая реакция изменяет состав и структуру вещества. В результате необратимой реакции образуются новые вещества с другими свойствами и структурой, которые невозможно преобразовать обратно в исходные реагенты.
- Необратимая реакция происходит без обратимости тепловой и энергетической реакции. В отличие от обратимых реакций, необратимые реакции обычно сопровождаются выделением или поглощением большого количества тепла и энергии, которые нельзя вернуть обратно в систему.
- Необратимая реакция происходит с изменением энтропии системы. Энтропия системы, то есть мера хаоса или беспорядка, увеличивается при необратимой реакции. Это означает, что система становится менее упорядоченной и более хаотичной, что делает обратную реакцию невозможной.
Необратимые реакции являются фундаментальной особенностью химической кинетики и имеют важное значение во многих процессах, таких как синтез новых веществ, разложение материалов, сжигание топлива и многие другие. Понимание принципа необратимости реакций помогает химикам управлять и оптимизировать процессы в промышленности и технологии.
Реакции с высокой степенью необратимости

Некоторые химические реакции имеют высокую степень необратимости, что означает, что они происходят только в одном направлении и не могут обратиться к исходным реагентам. Такие реакции обычно характеризуются сильным смещением равновесия и высокой скоростью протекания.
Примером таких реакций являются реакции окисления и восстановления. Во время окисления одни вещества теряют электроны, а другие вещества получают электроны в результате восстановления. Электронный перенос в этих реакциях происходит неравномерно, и, как следствие, равновесие не может быть достигнуто. Окислитель и восстановитель переходят в состояние окисленных и восстановленных форм, соответственно, и реагенты не могут быть восстановлены к исходному состоянию.
Еще одним примером реакции с высокой степенью необратимости является гидролиз солей. При гидролизе соли, ионные связи в молекуле соли разрушаются, и ионы соединения реагируют с водой. Эта реакция протекает только в одном направлении и окончательными продуктами являются ионы соли и ионы воды, которые не могут обратно образовать молекулу соли.
Реакции с высокой степенью необратимости обладают широкими промышленными и биологическими приложениями, так как их направленность и скорость позволяют эффективно проводить реакции с высокими выходами продуктов или направлять их в нужное русло. Такие реакции играют важную роль в многих процессах, включая химическую синтез и обмен веществ в живых организмах.
Физические и химические причины необратимости
Необратимые реакции в химии обусловлены сочетанием физических и химических причин. Физические причины определяются природой веществ, их агрегатным состоянием, температурой и давлением, которые могут препятствовать обратной реакции.
Одним из примеров физических причин является образование нерастворимых осадков. В некоторых реакциях происходит образование продуктов, которые плохо растворимы в реакционной среде. Нерастворимые осадки неблагоприятно влияют на возвратную реакцию, так как они могут выпадать в осадок и удалиться из системы.
Параллельно физическим причинам, химические причины также способствуют необратимости реакций. Одним из примеров является угасание активности катализатора. Катализаторы играют важную роль в химических реакциях, ускоряя их процесс. Однако со временем катализатор может деградировать или быть вовлеченным в другие реакции, что приводит к потере его активности и невозможности обратной реакции.
Также, одной из химических причин необратимости является неравновесность концентрации реагентов и продуктов. В реакциях, где концентрация продуктов значительно превышает концентрацию реагентов, обратная реакция может быть затруднена из-за низкой концентрации реагентов в системе.
Следовательно, физические и химические причины необратимости в химических реакциях могут быть связаны с образованием нерастворимых осадков, угасанием активности катализаторов и дисбалансом концентрации реагентов и продуктов. Эти факторы создают неравновесные условия, препятствуя обратной реакции и делая реакцию необратимой.
Примеры необратимых реакций
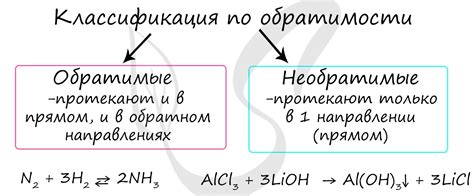
Необратимые реакции в химии происходят без возможности восстановления исходных реагентов. Вот несколько примеров таких необратимых реакций:
- Горение: при сжигании древесины или бумаги происходит окисление углеводородных соединений, образуя оксиды углерода и воду. Эта реакция является необратимой, так как невозможно восстановить древесину или бумагу из продуктов горения.
- Растворение: когда соль растворяется в воде, образуется ионный раствор, исходная соль не может быть восстановлена из раствора.
- Окислительно-восстановительные реакции: например, реакция между кислородом и металлами, при которой металл окисляется, а кислород восстанавливается. Эти реакции являются необратимыми, так как невозможно вернуть исходное состояние металла и кислорода.
Это лишь несколько примеров необратимых реакций, которые происходят в химии. Необратимые реакции играют важную роль в многих процессах, таких как сжигание топлива, пищеварение, обработка материалов и другие.
Практическое использование необратимых реакций
Необратимые реакции также используются для образования осадков и осадочных пород в геологических процессах. Например, такие реакции помогают формированию кристаллов минералов в рамках геологического цикла. Они также влияют на окислительно-восстановительные реакции в геохимических процессах, что важно для понимания состава и структуры земных пород.
Кроме того, необратимые реакции широко применяются в биохимии и фармацевтической промышленности. Они позволяют эффективно синтезировать лекарственные препараты и химические соединения, которые не подвержены обратным превращениям в теле человека. Такие необратимые реакции способствуют увеличению стабильности и эффективности препаратов, а также позволяют контролировать их длительность действия.




