Молекула - это основная структурная единица вещества, состоящая из атомов, связанных между собой химическими связями. В физике, изучающей микромир и его взаимодействие, молекулы играют важнейшую роль, определяя свойства вещества и его поведение в различных условиях.
Молекулы могут быть различных видов, в зависимости от количества и типа атомов, которые их составляют. Некоторые молекулы состоят из одного вида атомов и называются элементарными, например, молекула кислорода (O2) или молекула азота (N2). Другие содержат разные виды атомов и называются соединениями, например, молекула воды (H2O), которая состоит из атомов водорода и атома кислорода.
Молекулы имеют свои химические и физические свойства, которые влияют на их взаимодействие с окружающей средой. Например, свойства таких молекул, как вода или углекислый газ (CO2), играют важную роль в жизнедеятельности всего живого на планете, а также в климатических процессах. Изучение молекул позволяет лучше понять принципы функционирования вещества и разрабатывать новые материалы и технологии.
Молекула в физике: основные понятия и определение
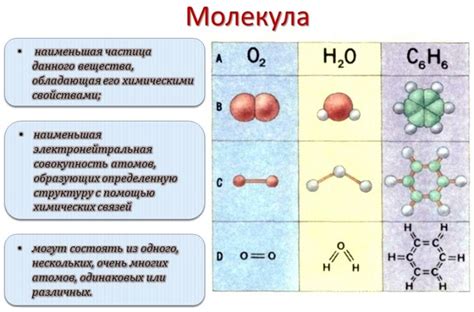
Молекулы могут быть одноатомными, содержащими только один тип атомов, или многоатомными, состоящими из двух или более различных атомов. Важно отметить, что в молекулах атомы не существуют отдельно друг от друга, они взаимодействуют и образуют структуру, обладающую определенными свойствами.
Молекулы могут быть представлены в виде трехмерных моделей, отражающих расположение атомов в пространстве. Они имеют определенную форму и размеры, что влияет на их химические и физические свойства.
Химические связи между атомами в молекуле определяют ее устойчивость, а также возможность взаимодействия с другими молекулами и веществами. Эти связи могут быть ковалентными, ионными или металлическими, что влияет на степень силы и энергии, необходимой для их разрыва или образования.
Молекулы играют важную роль в понимании различных физических явлений. Исследование структуры и свойств молекул позволяет нам лучше понять механизмы химических реакций, электромагнитное взаимодействие между веществами, термодинамические процессы и многое другое.
| Основные понятия и определение | |
|---|---|
| Молекула | наименьшая единица вещества, обладающая химическими связями между атомами |
| Одноатомные молекулы | содержат только один тип атомов |
| Многоатомные молекулы | состоят из двух или более различных атомов |
| Трехмерные модели молекул | отражают расположение атомов в пространстве |
| Химические связи | между атомами определяют устойчивость и взаимодействие молекул с другими веществами |
Структура молекулы и ее составные части
Молекулы состоят из атомов, которые могут быть одного или разных элементов. Внутри молекулы атомы могут соединяться различными типами химических связей, такими как ковалентные, ионные или металлические связи. Ковалентные связи являются самыми распространенными в органических молекулах.
В составе молекулы могут присутствовать различные функциональные группы. Функциональные группы - это группы атомов, которые придают молекуле определенные химические свойства и реакционную активность. Примеры функциональных групп в органических молекулах включают гидроксильную группу (-OH), карбоксильную группу (-COOH) и амино-группу (-NH2).
Молекулы могут иметь различные формы и геометрические конфигурации, которые могут влиять на их физические и химические свойства. Например, молекулы могут быть линейными, плоскими или трехмерными. Их геометрия может быть определена такими параметрами, как угол между связями и длины связей между атомами внутри молекулы.
Типы связей между атомами в молекуле
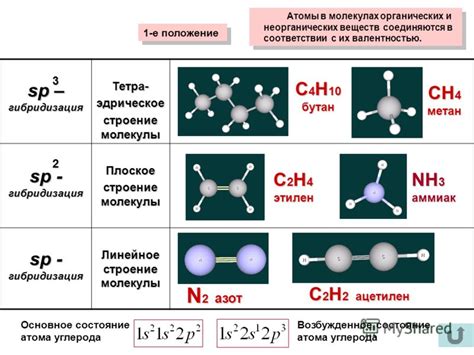
В молекуле атомы связаны между собой различными типами химических связей, которые определяют ее характеристики и свойства. В физике выделяют несколько основных типов связей:
1. Ковалентная связь: эта связь формируется, когда два атома обменивают электроны, чтобы достичь стабильной конфигурации. Общие электроны образуют пару, которую можно представить как область, где существуют оба атома. Ковалентная связь наиболее распространена в органических молекулах.
2. Ионическая связь: данная связь возникает между атомами, которые образуют положительные и отрицательные ионы. Привлекательные силы между положительными и отрицательными зарядами этих ионов формируют ионную связь. Этот тип связи характерен для солей и некоторых неорганических соединений.
3. Металлическая связь: данный тип связи возникает между атомами металлов. В металлической связи электроны образуют облако, общее для всех атомов металла. Это облегчает передачу электрического тока и тепла, что объясняет хорошую проводимость металлов.
4. Ван-дер-Ваальсовы силы: это слабая притяжательная сила, которая возникает между нейтральными молекулами или атомами. Ван-дер-Ваальсовы силы играют важную роль в молекулярном взаимодействии и способностях вещества.
Знание о типах связей между атомами в молекуле позволяет лучше понять и описать характеристики и свойства вещества и является фундаментальным в изучении физики молекул.
Масса молекулы и ее измерение
Измерение массы молекулы является важной задачей в физике. Существуют различные методы измерения, позволяющие определить массу молекулы с высокой точностью.
Один из таких методов – это масс-спектрометрия. Она основана на разделении ионов по их отношению массы к заряду. Этот метод позволяет определить массу молекулы и узнать ее состав.
Другой метод – это гравиметрический анализ. Он основан на определении изменения массы вещества при химических реакциях. С помощью гравиметрии можно измерить массу молекулы, используя несколько химических реакций и взвешивание реагентов и продуктов.
Также существуют специальные приборы – масспектрометры, которые позволяют измерять массу молекулы непосредственно. Они работают на основе ионизации молекул и их разделения по массе и заряду.
Измерение массы молекулы имеет большое значение в различных областях науки и техники. Это позволяет узнать состав вещества, определить его свойства и влияние на окружающую среду.
Физические и химические свойства молекулы

Физические свойства молекулы включают в себя массу, размеры, форму, плотность и точку кипения или плавления. Масса молекулы определяется суммой масс атомов, входящих в ее состав. Размеры и форма молекулы зависят от типа и количества атомов, а также от типа их связей. Плотность молекулы характеризует ее массу в единице объема и зависит от массы и объема молекулы. Точка кипения и точка плавления определяются силой взаимодействия молекул и зависят от их состава и структуры.
Химические свойства молекулы связаны с ее способностью участвовать в химических реакциях. Молекула может быть агентом, катализатором или реагентом в различных химических процессах. Она может образовывать связи с другими молекулами, образуя новые химические соединения. Химические свойства молекулы определяют ее активность и реакционную способность, что позволяет участвовать в различных химических процессах и образовывать разнообразные вещества.
Таким образом, физические свойства молекулы определяют ее физическое поведение в различных условиях, а химические свойства указывают на ее роль в химических процессах и взаимодействиях. Понимание этих свойств молекулы позволяет более глубоко изучать как физические, так и химические процессы, в которых она участвует.
Взаимодействие молекул в различных состояниях вещества
Молекулы, в зависимости от своего состояния, взаимодействуют между собой по-разному. В газообразном состоянии молекулы находятся на больших расстояниях друг от друга и их взаимодействие слабое. Они сталкиваются с другими молекулами и совершают хаотические движения, обладающие высокой энергией.
В жидком состоянии молекулы находятся ближе друг к другу и их взаимодействие сильнее. Они образуют более упорядоченные структуры, где силы притяжения между молекулами перевешивают силы отталкивания. Молекулы жидкости могут перемещаться друг относительно друга, однако они не могут свободно расходиться в пространстве, как в газе.
В твердом состоянии молекулы находятся очень близко друг к другу и их взаимодействие еще сильнее. Они образуют регулярную и кристаллическую структуру, где молекулы занимают определенные позиции в пространстве. Взаимодействие между молекулами твердого вещества не позволяет им свободно перемещаться.
Роль молекул в химических реакциях

Молекулы могут соединяться или разлагаться в результате химической реакции, образуя новые вещества. В таких реакциях молекулы переходят из одного состояния вещества в другое, изменяя свою структуру и свойства.
Молекулярная структура вещества определяет его химические свойства и поведение в реакциях. Энергия, необходимая для изменения состояния молекулы, поставляется или поглощается во время химической реакции.
Реакции между молекулами могут быть эндотермическими, в которых поглощается энергия, или экзотермическими, в которых выделяется энергия. Часто химические реакции сопровождаются изменениями температуры, света или звука.
Молекулы принимают участие в различных типах реакций, включая окислительно-восстановительные, кислотно-щелочные, обменные, полимеризационные и дегидрационные реакции. Каждая из этих реакций имеет свою специфическую молекулярную механику и влияет на структуру и свойства вещества.
Роль молекул в химических реакциях не может быть переоценена. Их взаимодействие и перестройка являются основой для создания новых веществ и материалов, разработки лекарств и производства энергии. Понимание молекулярных процессов в химических реакциях ключевое для развития химии и применения ее в различных областях науки и технологии.
Примеры молекул и их историческая значимость
Молекулы играют важную роль в нашей жизни и имеют историческую значимость в разных областях науки и технологий. Ниже приведены несколько примеров молекул и их важность в различных сферах деятельности:
| Молекула | Историческая значимость |
|---|---|
| ДНК (дезоксирибонуклеиновая кислота) | Открытие структуры ДНК Хатомом и Криком в 1953 году сыграло решающую роль в понимании генетики и эволюции жизни на Земле. Молекула ДНК ответственна за хранение и передачу генетической информации в организмах. |
| Азотистый оксид (NO) | Открытие азотистого оксида в 1772 году Джозефом Прёстли помогло понять его важную роль в биологических процессах и функции сигнального молекулы. Азотистый оксид играет важную роль в регуляции кровяного давления и имеет широкое применение в медицине. |
| Фуллерены (C60, C70) | Открытие фуллеренов в 1985 году Хари Кротосом и Робертом Керри Фуллером привело к открытию нового класса углеродных особенностей и развитию области нанотехнологий. Фуллерены имеют потенциальное применение в электронике, катализе и медицине. |
| Аспирин (асетилсалициловая кислота) | Открытие аспирина в 1897 году Феликсом Хоффманном привело к разработке первого синтетического препарата от боли и воспаления. Аспирин стал одним из самых распространенных и широко используемых лекарственных средств в мире. |
Это лишь небольшой список молекул, которые имеют историческую значимость. Молекулы играют решающую роль в разных областях науки и технологий, от генетики и медицины до материаловедения и энергетики.




