Мир, в котором мы живем, полон разнообразных материалов, которые окружают нас повсюду. От мебели и одежды до еды и космических кораблей - все они состоят из молекул. Однако, как эти молекулы взаимодействуют друг с другом, чтобы создать все видимые вещества?
Одним из основных факторов, определяющих взаимодействие молекул, являются силы отталкивания. Когда молекулы приближаются друг к другу, они взаимодействуют с помощью этих сил, которые могут быть как притягивающими, так и отталкивающими. Силы отталкивания возникают в результате взаимодействия зарядовых частиц, находящихся внутри молекулы.
Одним из примеров силы отталкивания является отталкивание двух одинаковых положительно заряженных молекул. Приближаясь друг к другу, они начинают отталкиваться, поскольку заряды одинаковы и сталкиваются прямо между собой. Это пример отталкивающей силы между молекулами, которая не позволяет им сближаться на близкое расстояние.
Однако, не все силы отталкивания настолько сильны, чтобы предотвратить сближение молекул. Существуют различные механизмы, которые могут преодолеть эти силы и позволить молекулам образовывать связи и образовывать различные структуры вещества. Изучение этих механизмов позволяет нам более глубоко понять природу вещества и его свойства, а также применить этот знак для создания новых материалов и технологий.
Понятие отталкивания между молекулами

Отталкивание между молекулами возникает из-за наличия зарядов разного знака на поверхности молекул. Подобно полюсам магнита, заряды притягиваются, если они имеют разные знаки, и отталкиваются, если они имеют одинаковые знаки.
Отталкивание между молекулами влияет на многие свойства вещества, такие как его плотность, вязкость, объемные изменения при нагревании или охлаждении и т. д. К примеру, вода имеет высокую плотность благодаря тому, что молекулы воды притягиваются друг к другу, образуя сеть отрицательно заряженных водородных связей.
Отталкивание между молекулами также играет значительную роль в химических реакциях и фазовых переходах. Взаимодействие молекул с другими молекулами может стимулировать реакцию или затруднить ее протекание.
Понимание отталкивания между молекулами является важным для разработки новых материалов, лекарственных препаратов и технологий. Ученые изучают эти силы, чтобы лучше понять структуру веществ и выяснить, как они взаимодействуют друг с другом.
Как возникает отталкивание между молекулами?
Молекулы состоят из атомов, которые, в свою очередь, содержат электроны, имеющие отрицательный заряд, и протоны, имеющие положительный заряд. Под действием электрических сил электроны отталкивают друг друга, поскольку одни электроны стремятся находиться на большем удалении от других электронов в атмосфере атома. Это приводит к возникновению отталкивания между молекулами.
Второй фактор, который вносит вклад в возникновение силы отталкивания, - это принцип сочетаемости занятых электронными орбиталями. Он обусловлен тем, что атомы стремятся занимать орбитали таким образом, чтобы минимизировать энергию системы. Если при приближении молекул электроны из занятых орбиталей не могут совместно существовать, то энергия системы увеличивается, и это приводит к отталкиванию.
Силы отталкивания между молекулами играют ключевую роль во многих процессах, таких как растворение веществ, образование жидкостей и газов, а также фазовые переходы. Понимание механизмов возникновения отталкивания между молекулами позволяет лучше понять и объяснить свойства веществ и их поведение в различных условиях.
Влияние отталкивания на свойства вещества

Отталкивающие силы между молекулами играют важную роль в определении свойств вещества. Они оказывают влияние на его физические и химические свойства, а также на его агрегатное состояние.
Когда молекулы вещества находятся близко друг к другу, силы отталкивания начинают действовать. Эти силы возникают из-за электростатического отталкивания между зарядами внутри молекул. Когда заряды молекул одного вещества становятся близкими, они начинают взаимодействовать и отталкиваться друг от друга.
Влияние отталкивания на свойства вещества проявляется в его плотности, вязкости и твердости. Если молекулы вещества слишком близко расположены друг к другу из-за сильного отталкивания, вещество будет обладать высокой плотностью. Если же молекулы слабо отталкиваются, вещество будет иметь низкую плотность.
Однако не только плотность, но и вязкость вещества может быть связана с отталкиванием между молекулами. Если силы отталкивания между молекулами вещества слабые, молекулы перемещаются относительно свободно друг от друга, и вещество будет обладать низкой вязкостью. Если же силы отталкивания сильные, молекулы будут двигаться медленно и вещество будет вязким.
Также отталкивание между молекулами может влиять на твердость вещества. Если силы отталкивания между молекулами сильные, они будут затруднять перемещение друг относительно друга, и вещество будет твердым. Если же силы отталкивания слабые, молекулы могут свободно перемещаться, и вещество будет мягким.
Роль межмолекулярных сил в природе
Межмолекулярные силы играют важную роль во многих аспектах природы и влияют на различные физические и химические свойства веществ.
Притяжение и отталкивание молекул определяют такие фундаментальные явления, как агрегатные состояния вещества – твердое, жидкое и газообразное. Притяжение между молекулами способствует их сближению, а отталкивание препятствует этому процессу.
Межмолекулярные силы также влияют на поверхностное натяжение, которое определяет способность жидкостей к образованию капель и пузырей. Силы, действующие на молекулы на поверхности жидкости, обуславливают их сжимаемость и вязкость.
Силы отталкивания также играют важную роль в биологических системах, например, взаимодействуя между клетками, антителами и антигенами.
Таким образом, межмолекулярные силы являются неотъемлемой частью физических и химических процессов в природе, определяя множество физических и химических свойств веществ и играя важную роль в различных биологических системах.
Межмолекулярные силы во взаимодействии веществ
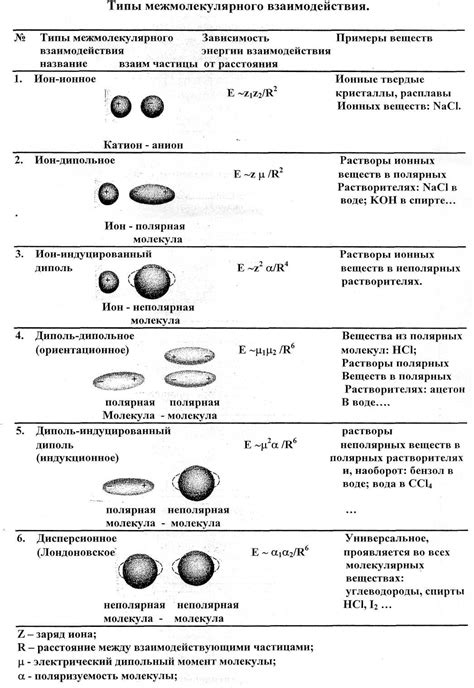
Существует несколько типов межмолекулярных сил, которые могут возникать между молекулами. Это ван-дер-ваальсовы силы, диполь-дипольные взаимодействия и водородные связи.
Ван-дер-ваальсовы силы являются слабыми электростатическими силами притяжения между нейтральными атомами или молекулами. Они возникают из-за временных изменений в распределении электронной плотности вокруг атомов или молекул.
Диполь-дипольные взаимодействия возникают между молекулами, имеющими постоянный дипольный момент. Эти силы приводят к ориентации молекул таким образом, чтобы положительные и отрицательные заряды взаимодействовали.
Водородные связи – это особый тип диполь-дипольных взаимодействий, который возникает между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрицательным атомом другой молекулы.
Межмолекулярные силы влияют на физические свойства веществ, такие как точка кипения, температура плавления и плотность. Они также могут влиять на химические свойства, например, на реакционную активность веществ.
Общая важность межмолекулярных сил взаимодействия веществ подчеркивает необходимость изучения этого явления в области химии и физики.




