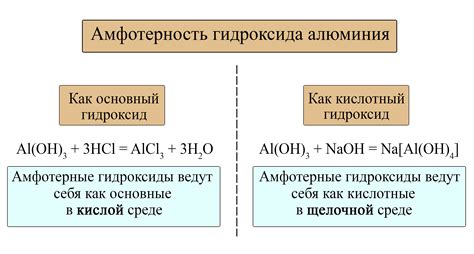
Амфотерные гидроксиды – это химические соединения, которые обладают способностью растворяться как в кислотах, так и в щелочах. Это особенное свойство позволяет им вести себя как амфотерные вещества, то есть проявлять как свойства кислот, так и свойства щелочей.
Взаимодействие амфотерных гидроксидов с кислотами происходит по схеме образования солей и воды. При этом гидроксид образует ион OH-, который соединяется с положительно заряженным ионом кислоты, образуя соль. В процессе такой реакции выделяется тепло. Примером такого взаимодействия может быть реакция между амфотерным гидроксидом алюминия Al(OH)3 и соляной кислотой HCl:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Аналогично, амфотерные гидроксиды реагируют с щелочами, образуя соли и воду. Взаимодействие остатков OH- гидроксила с отрицательно заряженными ионами щелочи приводит к образованию соли. Реакция также сопровождается выделением тепла. Например, реакция между гидроксидом алюминия и гидроксидом натрия может выглядеть следующим образом:
Al(OH)3 + 3NaOH → Na3Al(OH)6
Таким образом, амфотерные гидроксиды обладают уникальными свойствами и являются важным объектом исследований в области химии. Изучение их растворения в кислотах и щелочах позволяет более полно понять их химические свойства и потенциальные применения в различных областях науки и техники.
Общая характеристика амфотерных гидроксидов

Амфотерные гидроксиды имеют сложную структуру, состоящую из металл-оксидных компонентов и воды. Благодаря этой структуре, они могут образовывать ионы в растворе, что делает их активными взаимодействующими агентами.
Важной особенностью амфотерных гидроксидов является их способность образовывать гидроксокомплексы, которые могут быть как положительно, так и отрицательно заряженными. Это зарядовое разделение позволяет им проявлять амфотерные свойства, взаимодействуя как с кислотами, так и с щелочами.
Амфотерные гидроксиды имеют широкий спектр применения. Они используются в производстве крахмала, целлюлозы, некоторых керамических материалов, а также в производстве электролитических аккумуляторов. Кроме того, они находят применение в медицине, при производстве лекарств и косметики.
Структура амфотерных гидроксидов
Большинство амфотерных гидроксидов имеют сложную кристаллическую структуру. Они образуют трехмерные кристаллические решетки, в которых ионы металла и группы гидроксила между собой образуют структуры с определенным порядком и симметрией.
Структура амфотерных гидроксидов включает две основные части: ионы металла и группы гидроксила. Ионы металла обычно имеют положительный заряд и могут быть одноатомными или комплексными. Группы гидроксила представляют собой один атом кислорода и один атом водорода, связанные ковалентной связью.
Структура амфотерных гидроксидов также включает анионы, которые окружают ионы металла и группы гидроксила. Анионы могут быть различного типа в зависимости от вида гидроксида. Например, для амфотерных гидроксидов алюминия используется анион ОН-, а для амфотерных гидроксидов железа - анион FeO(OH).
Кристаллическая структура амфотерных гидроксидов может быть сложной и разнообразной в зависимости от иона металла, аниона и условий образования соединения. Это создает различные свойства и реакционную активность амфотерных гидроксидов в кислотах и щелочах.
Изучение структуры амфотерных гидроксидов позволяет лучше понять их физические и химические свойства, а также возможности их использования в различных областях, таких как катализ, электрохимия и материаловедение.
Реакции растворения амфотерных гидроксидов в кислотах
Амфотерные гидроксиды способны растворяться как в щелочных, так и в кислотных средах. Рассмотрим реакции растворения амфотерных гидроксидов в кислотах:
- Растворение гидроксида алюминия (Al(OH)3) в кислотах:
- При растворении гидроксида алюминия в соляной кислоте (HCl), происходит образование кислого алюминиевого хлорида (AlCl3) и воды (H2O).
- Аналогичная реакция наблюдается и с другими кислотами, например с серной (H2SO4), нитратной (HNO3) и фосфорной (H3PO4) кислотами.
- При растворении гидроксида цинка в соляной кислоте (HCl), образуется солянокислый цинкат (ZnCl2) и вода (H2O).
- Аналогичные реакции происходят и с другими кислотами, включая серную (H2SO4), уксусную (CH3COOH) и фосфорную (H3PO4) кислоты.
- При растворении гидроксида свинца в соляной кислоте (HCl), образуется хлорид свинца (PbCl2) и вода (H2O).
- Аналогичные реакции наблюдаются и с серной (H2SO4), уксусной (CH3COOH) и другими кислотами.
Таким образом, амфотерные гидроксиды проявляют свои амфотерные свойства и растворяются в кислотах с образованием солей и воды.
Влияние pH на растворение амфотерных гидроксидов в кислотах
Амфотерные гидроксиды представляют собой вещества, которые могут растворяться как в кислотах, так и в щелочах. В данном разделе рассмотрим влияние pH на процесс растворения амфотерных гидроксидов в кислотах.
pH является мерой кислотности или щелочности раствора и определяется концентрацией ионов водорода (H+). При низком значении pH раствор считается кислотным, при высоком - щелочным. Изменение pH раствора может оказывать существенное влияние на растворение амфотерных гидроксидов.
В кислотных растворах амфотерные гидроксиды соединяются с лишними ионами водорода (H+) и образуют соли. Процесс растворения может быть описан следующей химической реакцией:
Am(OH) + H+ → Am+ + H2O
Где Am(OH) - амфотерный гидроксид, H+ - ион водорода, Am+ - ион металла.
При повышении pH раствора кислотности уменьшается, а щелочности увеличивается. Это связано с тем, что концентрация ионов водорода (H+) снижается, что препятствует соединению гидроксидов с ионами H+ и способствует растворению амфотерных гидроксидов.
Важно отметить, что процесс растворения амфотерных гидроксидов в кислотах зависит от химической природы самого гидроксида и свойств кислотного раствора. Некоторые амфотерные гидроксиды могут проявлять большую растворимость в кислотных средах, в то время как другие могут быть менее растворимыми.
Таким образом, pH играет важную роль в растворении амфотерных гидроксидов в кислотах. Оптимальное pH для растворения может быть достигнуто путем регулирования концентрации ионов водорода в растворе. Это имеет практическое значение при использовании амфотерных гидроксидов в химической промышленности и других областях.
Реакции растворения амфотерных гидроксидов в щелочах
Процесс растворения амфотерных гидроксидов в щелочах может быть представлен общим уравнением:
M(OH)n + 2NaOH → Na2M(OH)2 + H2O
Где M - металл из группы амфотерных элементов, таких как алюминий, железо, цинк и другие. n - степень гидратации гидроксида металла.
Стоит отметить, что растворение амфотерных гидроксидов в щелочах зависит от рН раствора и концентрации гидроксида. Чем выше концентрация щелочи, тем более интенсивно проходит реакция растворения. Также важно учитывать рН среды, поскольку растворение амфотерных гидроксидов происходит наиболее эффективно в щелочных условиях.
Реакции растворения амфотерных гидроксидов в щелочах являются важным аспектом химической науки и находят широкое применение в различных промышленных и лабораторных процессах. Знание данных реакций позволяет более эффективно управлять составом и свойствами растворов, а также использовать амфотерные гидроксиды в различных химических преобразованиях и технологических процессах.
Влияние pH на растворение амфотерных гидроксидов в щелочах
Когда растворение амфотерных гидроксидов в кислотах происходит, их ионы гидроксида (OH-) реагируют с протонами (H+) из кислоты, образуя воду (H2O). Однако врастворение в щелочах происходит в обратном направлении – ионы гидроксида уже находятся в растворе, и они реагируют с протонами, формируя анионы.
При увеличении pH раствора (т.е. увеличении концентрации гидроксид-ионов), происходит увеличение скорости растворения амфотерных гидроксидов в щелочах. Это связано с тем, что увеличение концентрации гидроксид-ионов обеспечивает большее количество реагентов для взаимодействия с протонами. Кроме того, при достаточно высоком уровне pH гидроксид-ионы становятся более активными и способными взаимодействовать с протонами.
При низком pH раствора, амфотерные гидроксиды плохо растворяются в щелочах. Это связано с недостаточным количеством гидроксид-ионов для взаимодействия с протонами.
Следует отметить, что концентрация ионообразующих гидроксилий и водородов обратно пропорциональна pH раствора. Таким образом, изменение pH влияет на растворение амфотерных гидроксидов, ведь pH указывает на интенсивность движения протонов и гидроксид-ионов в растворе.
Факторы, влияющие на скорость растворения амфотерных гидроксидов

Скорость растворения амфотерных гидроксидов в кислотах и щелочах может зависеть от нескольких факторов:
- Концентрация растворителя: Чем выше концентрация растворителя, тем быстрее гидроксид растворяется. Увеличение концентрации растворителя увеличивает число коллизий между молекулами растворителя и гидроксидом, что ускоряет процесс растворения.
- Температура раствора: Повышение температуры увеличивает кинетическую энергию молекул гидроксида и растворителя, что приводит к увеличению скорости реакции растворения. Однако нужно учитывать, что некоторые амфотерные гидроксиды могут разлагаться при высоких температурах.
- Растворимость гидроксида: Растворимость гидроксида зависит от его ионной силы и растворимости в растворителе. Чем выше ионная сила гидроксида, тем медленнее он будет растворяться. Также, если растворимость гидроксида невелика, то скорость его растворения будет низкой.
- РХ-потенциал раствора: Величина растворимости амфотерных гидроксидов может зависеть от pH-потенциала раствора. Высокий pH может способствовать растворению кислых окислов металла и образованию соответствующих ионов. Однако, низкий pH может вызвать образование кислотных окислов металла, что затруднит растворение гидроксида.
- Размер и структура гидроксида: Растворение гидроксида может зависеть от его размера и структуры. Например, мелкодисперсные гидроксиды могут иметь большую поверхностную активность и быстрее растворяться, чем крупнодисперсные. Также, структура источника гидроксида может влиять на скорость его растворения, так как она может определять наличие доступных поверхностных активных центров.
Учитывая эти факторы, можно оптимизировать условия для достижения максимальной скорости растворения амфотерных гидроксидов в кислотах и щелочах.
Применение амфотерных гидроксидов в промышленности и научных исследованиях
Амфотерные гидроксиды обладают уникальными свойствами, которые находят широкое применение в различных отраслях промышленности и научных исследованиях.
В промышленности амфотерные гидроксиды используются в качестве катализаторов, антиокислителей, абсорбентов и коагулянтов. Они находят применение в производстве бумаги, текстиля, стекла, керамики, пластмасс, фармацевтической и косметической промышленности.
Амфотерные гидроксиды также широко используются в научных исследованиях. Их уникальные свойства позволяют применять их в качестве модельных систем для изучения различных физико-химических процессов. Также они играют важную роль в области катализа, электрохимии, фотохимии и нанотехнологий.
Для более подробного исследования свойств амфотерных гидроксидов проводят спектроскопические исследования, анализируют их поверхность и структуру, изучают их реакционную способность и способность взаимодействовать с другими веществами.
Использование амфотерных гидроксидов в промышленности и научных исследованиях является важным шагом в развитии новых материалов и технологий. Благодаря своим уникальным свойствам, амфотерные гидроксиды обладают большим потенциалом в различных областях применения и могут стать основой для создания новых передовых материалов и технологий в будущем.




