Медь, один из самых известных химических элементов, обладает поразительными свойствами. Он является отличным проводником электричества, прекрасно подходит для создания декоративных изделий, и, кажется, устойчив ко множеству химических соединений. Однако, почему медь не реагирует с серной кислотой? Это явление вызывает интерес многих ученых, и в этой статье мы рассмотрим основные причины такого поведения меди в присутствии серной кислоты.
Серная кислота, известная также как королевская вода, является сильным окислителем. Она способна вступать в реакцию с многими металлами, такими как железо или алюминий, но почему медь не образует с ней химическую связь? Ответ заключается в особой структуре меди и ее поверхностных свойствах.
Корпус меди обычно покрывается тонкой пленкой оксида, которая препятствует проникновению серной кислоты на поверхность металла. Благодаря этому оксиду, возникает вольфрамовый слой, который действует как барьер, препятствующий дальнейшей реакции с серной кислотой. Таким образом, медь остается неповрежденной и не подвергается окислению в присутствии данного кислотного соединения.
Структура кристаллической решетки
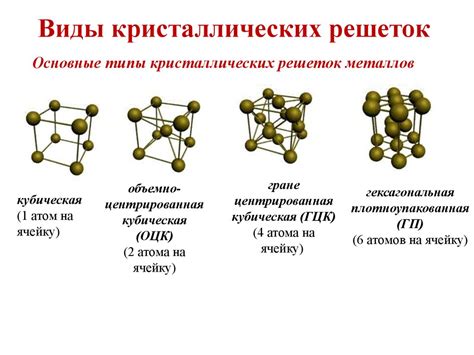
Структура кристаллической решетки меди называется гранецентрированной кубической решеткой. В этом типе решетки все углы ячейки имеют угол 90 градусов, а каждая грань содержит атом меди.
Каждый атом меди в решетке имеет 12 ближайших соседей, что обеспечивает кристаллу прочность и устойчивость. Такая структура позволяет меди сохранять свои физические и химические свойства при контакте с различными веществами, включая серную кислоту.
Наличие прочной кристаллической решетки объясняет, почему медь не реагирует с серной кислотой. Медь не оказывает воздействия на серную кислоту из-за своей устойчивой структуры, которая предотвращает реакции и изменения свойств металла.
Таким образом, структура кристаллической решетки меди играет важную роль в ее химической стойкости и способности сохранять свои физические свойства при контакте с различными реагентами.
Электрохимические свойства меди
Медь обладает высокими электрохимическими свойствами, благодаря которым она активно применяется в множестве отраслей науки и техники. Электрохимические свойства меди объясняются ее способностью образовывать разнообразные соединения и проявлять каталитическую активность.
Как известно, медь является хорошим проводником электричества и тепла. Это свойство объясняется наличием свободных электронов в металлической решетке, которые образуют так называемий «электронный газ». Кристаллическая структура меди позволяет легко перемещаться электронам, что обеспечивает металлу высокую электропроводность.
Однако, медь также обладает высокой химической активностью. Она способна реагировать с кислородом из воздуха, образуя оксиды и гидроксиды. Но при этом медь не реагирует с серной кислотой. Данное явление объясняется тем, что оксид меди, образующийся в реакции с кислородом, обладает защитными свойствами и способен предотвращать дальнейшую реакцию меди с кислотой.
Кроме того, медь может принимать участие в электрохимических реакциях, таких как окислительно-восстановительные процессы. В электролите медь образует два типа ионов - меди(I) и меди(II). Однако, при нормальных условиях, медь(II) является более стабильным ионом.
Таким образом, электрохимические свойства меди позволяют ей проявлять активность в различных реакциях, включая окислительно-восстановительные и каталитические процессы. Уникальные свойства меди делают ее важным материалом в таких областях как электротехника, химическая промышленность и катализ.
Реакционная способность серной кислоты
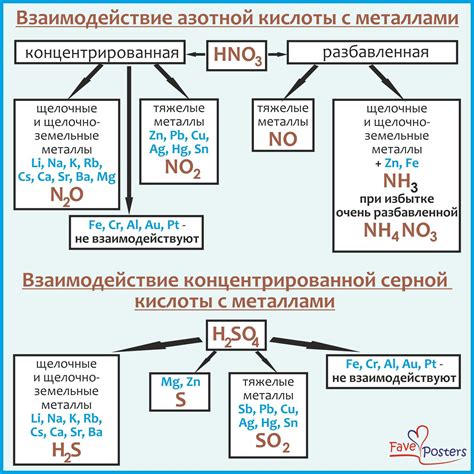
В то время как медь (Cu) является активным металлом, она обладает устойчивой поверхностной пленкой оксида, которая формируется при контакте с кислородом в воздухе. Эта пленка предотвращает дальнейшую реакцию меди с окружающей средой, включая серную кислоту.
Когда медь вступает в контакт с серной кислотой, поверхностная пленка оксида меди предотвращает прямую реакцию. Однако, в случае длительного воздействия серной кислоты на медь или в условиях повышенной температуры, медь может реагировать со средой, но в этом случае происходит растворение меди с образованием сульфатов меди и выделением газа водорода.
Таким образом, реакционная способность серной кислоты ограничена наличием у меди защитной оксидной пленки. Это явление обусловлено химическими свойствами самого металла и позволяет использовать медь в различных промышленных и бытовых целях без опасности реакции с серной кислотой.
Химический равновесие
В химическом равновесии протекают обратимые реакции, то есть реакции, которые могут протекать и в прямом, и в обратном направлении. В таких реакциях равновесие может быть достигнуто, когда скорость прямой реакции становится равной скорости обратной реакции.
При химическом равновесии концентрации реагентов и продуктов могут оставаться непостоянными, но их отношение, называемое константой равновесия, остается постоянным. Константа равновесия обозначается как K и может быть вычислена по формуле, которая связывает концентрации реагентов и продуктов.
Пример:
Рассмотрим реакцию между серной кислотой (H2SO4) и медью (Cu):
H2SO4 + Cu → CuSO4 + H2
Несмотря на то, что серная кислота является сильным окислителем и медь является хорошим восстановителем, данная реакция не происходит сразу. Вместо образования меди(II)сульфата и выделения водорода, ионы меди и серы образуют сложные соединения, и нарушение баланса зарядов оказывает тормозящее влияние на реакцию.
Об этом можно сказать, что реакция находится в химическом равновесии, где скорость обратной реакции (образование меди и серы из меди(II)сульфата и водорода) становится равной скорости прямой реакции (образование меди(II)сульфата и выделение водорода из меди и серной кислоты).
Образование защитной пленки
Медь не реагирует с серной кислотой благодаря образованию защитной пленки на поверхности металла. При контакте с серной кислотой происходит окисление меди, при котором образуется тонкая слой сульфида меди (CuS).
Защитная пленка сульфида меди предотвращает дальнейшее взаимодействие меди с серной кислотой. Она служит барьером, препятствующим проникновению кислоты к металлу и защищая его от коррозии.
Следует отметить, что образование защитной пленки на поверхности меди зависит от концентрации серной кислоты и времени взаимодействия. В некоторых условиях может происходить образование защитной пленки, но при более высоких концентрациях кислоты или длительном взаимодействии пленка может быть разрушена, что приведет к реакции меди с серной кислотой.
Взаимодействие с другими кислотами
Помимо серной кислоты, медь также не реагирует с рядом других кислот. Например, не отмечается реакция меди с соляной кислотой (HCl) или соляной серной (HF).
Такое поведение меди обусловлено ее относительной инертностью по отношению к кислотам. Медь обладает высокой устойчивостью к окислительным свойствам, что делает ее неподверженной атаке как мощных, так и слабых кислот.
Такой химический характер меди, безусловно, является преимуществом при использовании материала в различных областях, таких как нефтепереработка, энергетика и электроэнергетика, где контакт с кислотами неизбежен.




