Цинк - один из важнейших металлов, широко используемый в разных областях жизни человека. Он является не только незаменимым микроэлементом для организма, но и отличается отличной коррозионной стойкостью. Однако, в определенных условиях цинк способен растворяться.
Процесс растворения цинка в сульфате цинка основан на электрохимической реакции, происходящей на поверхности металла. Под воздействием сульфата цинка (ZnSO4) на поверхность цинка (Zn) образуется сложный комплексный ион [Zn(SO4)4]^(2-).
Переход цинка из твердого состояния в растворенное состояние является анодным окислительным процессом. Это связано с передачей электронов от цинка к сульфату. Также, процесс сопровождается падением pH раствора, что усиливает коррозию и способствует дальнейшему растворению цинка.
Интересно отметить, что растворение цинка может быть полезным процессом в некоторых технологических задачах. Например, его использование в гальванических батареях и производстве цинковых покрытий на металлических поверхностях. В то же время, растворение цинка может быть проблемой в некоторых сферах, таких как коррозия металлических конструкций и агрессивное воздействие на окружающую среду.
Физические и химические свойства цинка

Цинк обладает низкой температурой плавления и испарения, что делает его удобным для использования в различных промышленных процессах. Он имеет плотность 7,14 г/см³ и плавится при температуре около 419 градусов Цельсия. Также цинк обладает высокой электропроводностью и теплопроводностью.
Цинк хорошо растворим в кислотах, образуя соответствующие соли. Он обладает амфотерными свойствами и может растворяться как в кислых, так и в щелочных растворах. Например, цинк растворяется в сульфате цинка с образованием двухвалентного цинка и образованием сульфата водорода.
Цинк имеет способность образовывать амфотерные соединения и реагировать с различными элементами и соединениями. Он может вступать в реакцию с кислородом, образуя оксид цинка. Также цинк может реагировать с хлором, образуя хлорид цинка.
Цинк является важным элементом для многих биологических процессов. Он присутствует в составе различных ферментов и участвует в многих жизненно важных реакциях. Цинк также является неотъемлемым элементом в производстве литейных сплавов, гальванических элементов и других изделий.
Где можно встретить цинк
Помимо своего присутствия в руде, цинк также обнаруживается в различных природных материалах. Например, он может присутствовать в почвах, где играет важную роль в питании растений. Он также может быть содержимым в некоторых пищевых продуктах и воде.
Исторический интерес к цинку связан с его использованием в производстве металлов и сплавов. Оно было использовано для создания прочного и коррозионно-стойкого материала, широко применяемого в строительстве и производстве. Цинк также используется в производстве батарей, косметических продуктов, лекарственных препаратов и многих других продуктов.
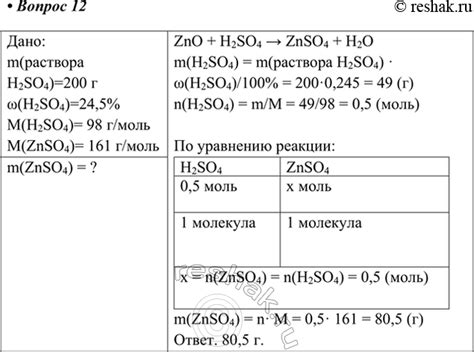
И наконец, цинк можно найти в различных формах в повседневных предметах и материалах. Он может быть применен в электронике, автомобильной промышленности, металлообработке и других отраслях промышленности.
Особенности взаимодействия цинка с сульфатом цинка
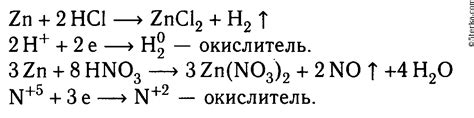
Когда кусок цинка помещается в раствор сульфата цинка, происходит окислительно-восстановительная реакция. Ионы цинка (Zn2+) переходят в раствор цинка (Zn2+(aq)), а при этом вода окисляется до кислородной молекулы (O2) и ионов водорода (H2). Реакция происходит с участием электродов, что позволяет использовать этот процесс в промышленности для получения металла.
Интересно, что раствор цинка образованный при взаимодействии с сульфатом цинка обладает антибактериальными свойствами и используется в медицине для лечения некоторых заболеваний.
Процесс растворения цинка в сульфате цинка
Этот процесс может быть описан следующей химической реакцией:
Zn (синий цинк) + ZnSO4 (сульфат цинка) → 2Zn2+ (ионы цинка) + SO42- (ионы сульфата)
Когда цинк погружается в раствор сульфата цинка, происходит окислительно-восстановительная реакция. Частицы цинка покрываются слоем ионов цинка, которые переходят в раствор в виде положительно заряженных ионов Zn2+. Уровень pH раствора влияет на скорость растворения цинка в сульфате цинка. Низкий pH способствует более быстрому растворению цинка, в то время как высокий pH может замедлить этот процесс.
Растворение цинка в сульфате цинка возможно благодаря разнице в электрохимическом потенциале между цинком и ионами цинка в растворе. Эта разница создает электрохимическую ячейку, в которой цинковая поверхность является анодом, а ионы цинка в растворе - катодом. Под воздействием электролита (сульфата цинка), электроны переносятся от анода (цинковая поверхность) к катоду (ионы цинка в растворе), что вызывает растворение цинка.
Таким образом, процесс растворения цинка в сульфате цинка является сложным и включает в себя окислительно-восстановительные реакции, электрохимические ячейки и образование ионов цинка в растворе.
Главный фактор, влияющий на растворение цинка

Ключевым моментом этого процесса является образование ионов цинка (Zn2+), которые переходят из твердой фазы в раствор. Данная реакция описывается уравнением:
Zn(s) → Zn2+(aq) + 2e-
В результате этой реакции, атомы цинка расщепляются на ионы цинка и электроны. Ионы цинка, находясь вводу, омываются раствором сульфата цинка, а электроны переходят на поверхность металла, где и протекают различные процессы, связанные с электрохимической коррозией.
Эта реакция происходит под влиянием разности электрического потенциала между цинком и раствором сульфата цинка. Именно поэтому, чем больше разность потенциалов, тем быстрее происходит растворение цинка. Отметим, что такой процесс происходит при постоянном контакте твердой частицы цинка с раствором сульфата цинка. В результате постоянного растворения и образования новых частиц цинка, еще больше ионов переходит в раствор, что дает ускорение процесса растворения.
Таким образом, основным фактором, влияющим на растворение цинка в сульфате цинка, является электрохимическая реакция, в результате которой происходит образование ионов цинка, переходящих из твердой фазы в раствор под влиянием разности электрических потенциалов.
Кристаллическая решетка сульфата цинка
Решетка сульфата цинка состоит из катионов цинка (Zn2+) и анионов сульфата (SO42-). Катионы и анионы располагаются внутри решетки таким образом, что обеспечивается полная электрическая нейтральность соединения.
Каждый катион цинка окружен шестью анионами сульфата и имеет октаэдрическую координацию. Такая координация образуется из-за электростатического притяжения между катионом и анионами. Каждый анион сульфата окружен четырьмя катионами цинка, образуя тетраэдральную координацию.
Интересно отметить, что сульфатные кристаллы цинка не имеют запаха и вкуса, что делает их безопасными для использования в различных отраслях, в том числе в фармацевтической и косметической промышленности.
Решетка сульфата цинка является хорошим примером кристаллической структуры и исследование этой структуры позволяет лучше понять свойства и поведение соединения.
Экспериментальные данные и механизм растворения цинка
Одним из основных методов исследования растворения цинка является измерение изменения массы образца в процессе эксперимента. В экспериментах обычно используются электролизеры с двумя электродами: анодом и катодом. Цинковый образец размещается на аноде, а сульфат цинка добавляется в раствор на катоде.
Во время эксперимента наблюдается, что масса цинкового образца уменьшается со временем, что свидетельствует о его растворении в сульфате цинка. Измерение этого изменения массы позволяет определить скорость растворения цинка и исследовать его зависимость от различных параметров, таких как концентрация и температура раствора.
Помимо измерения массы образца, в экспериментах также проводится анализ состава раствора, чтобы определить количество растворенного цинка и его ионную активность. Эти данные позволяют более детально изучить механизм растворения цинка в сульфате цинка.
Механизм растворения цинка в сульфате цинка до конца не изучен и все еще является предметом исследования. Однако существуют предположения о том, что процесс растворения происходит через образование комплексных ионов, включающих цинк и сульфатные группы. Эти ионы образуются в растворе и могут также играть важную роль в реакции редокс.
Экспериментальные данные и механизм растворения цинка представляют значимый вклад в понимание процессов, происходящих при взаимодействии цинка с сульфатом цинка. Дальнейшие исследования и эксперименты помогут расширить наши знания об этой реакции и улучшить практическое применение цинка и его соединений.
Влияние условий на растворение цинка в сульфате цинка
Концентрация: Концентрация сульфата цинка также оказывает влияние на скорость растворения цинка. При увеличении концентрации сульфата цинка, растворение цинка ускоряется. Это объясняется тем, что увеличение концентрации сульфата цинка приводит к увеличению количества доступных молекул для реакции растворения цинка, что способствует более быстрому протеканию реакции.
Ph: Кислотность (Ph) также может оказывать влияние на процесс растворения цинка в сульфате цинка. В щелочной среде растворение цинка происходит медленнее, в то время как в кислой среде происходит более быстрое растворение. Это связано с формированием ионов цинка и гидроксида в щелочной среде, которые могут снижать активность реакции растворения цинка.
Площадь поверхности: Увеличение площади поверхности цинка способствует более быстрому растворению в сульфате цинка. Это связано с тем, что при увеличении площади поверхности, больше молекул сульфата цинка имеют доступ к поверхности цинка, что увеличивает вероятность коллизии и, следовательно, скорость реакции растворения цинка.
В целом, условия, такие как температура, концентрация, кислотность и площадь поверхности, играют важную роль в процессе растворения цинка в сульфате цинка. Изменение этих условий может в значительной степени влиять на скорость реакции растворения цинка и, следовательно, на эффективность процесса.
Применение знаний о растворении цинка в сульфате цинка
Исследование растворения цинка в сульфате цинка имеет значительное практическое значение и находит применение в различных областях. Вот некоторые из них:
- Электрохимическая обработка поверхностей: процесс растворения цинка в сульфате цинка широко используется в гальванической обработке для нанесения покрытий на различные металлические детали. Это позволяет улучшить их защитные свойства, а также придать им привлекательный внешний вид.
- Производство батарей: растворение цинка в сульфате цинка применяется в производстве различных типов батарей, включая щелочные и кислотные. Цинк играет важную роль в реакциях, происходящих внутри батарей, и его растворение играет ключевую роль в обеспечении электрического тока.
- Медицина: знания о растворении цинка в сульфате цинка используются в медицине для разработки лекарственных препаратов, содержащих цинк. Цинк имеет важное значение для многих биологических процессов в организме человека, поэтому его эффективное растворение играет важную роль в разработке лекарственных средств.
- Корозионная защита: изучение растворения цинка в сульфате цинка позволяет разработать методы защиты металлов от коррозии. Нанесение цинкового покрытия на поверхность другого металла позволяет создать защитный барьер между металлом и окружающей средой, предотвращая его разрушение под воздействием агрессивных факторов.
Понимание процесса растворения цинка в сульфате цинка позволяет применять его для решения различных технических, медицинских и промышленных задач. Это дает возможность повысить эффективность производства, разработать новые лекарственные препараты, а также обеспечить долговечность металлических конструкций и изделий.




