Метан и аммиак - это два неорганических соединения, которые обладают сходными, но в то же время отличными друг от друга структурами. Метан является самым простым углеводородом, состоящим из одного атома углерода и четырех атомов водорода, в то время как аммиак - это соединение азота и водорода.
Молекула метана имеет геометрическую форму тетраэдра, где атом углерода находится в центре, а четыре атома водорода окружают его. Молекула аммиака, напротив, имеет форму пирамиды, где атом азота находится в вершине, а три атома водорода располагаются вокруг него.
Таким образом, основное отличие метана и аммиака по строению заключается в расположении атомов в молекулах. Это структурное различие влияет на химические свойства и реактивность данных соединений.
Строение метана и аммиака: основные различия
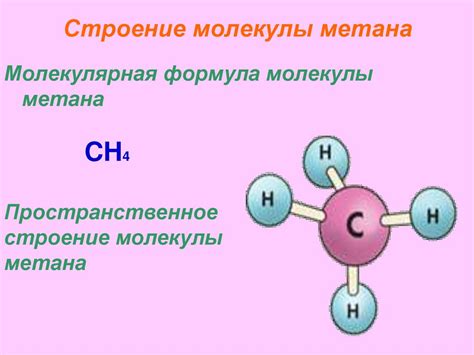
- Метан (CH4) - это наименьший представитель алканов, состоящий из одного атома углерода и четырех атомов водорода. Углеродный атом находится в центре молекулы, а четыре атома водорода расположены вокруг него. Молекула метана является тетраэдрической, то есть имеет форму четырехгранника со связанными атомами в вершинах.
- Аммиак (NH3) - это одно из простейших аминов, состоящее из одного атома азота и трех атомов водорода. Азотный атом находится в центре молекулы, а три атома водорода расположены вокруг него. Молекула аммиака имеет пирамидальную форму, где азот расположен в вершине пирамиды, а атомы водорода - на трех боковых гранях.
Таким образом, метан и аммиак имеют разное число атомов и разную конфигурацию связей между атомами. Эти различия в строении влияют на их физические и химические свойства, а также на способ взаимодействия с другими веществами.
Простая формула метана и аммиака
| Соединение | Простая формула |
|---|---|
| Метан | CH4 |
| Аммиак | NH3 |
Метан (CH4) состоит из одного атома углерода, связанного с четырьмя атомами водорода. Он является простейшим представителем алкановой серии и широко распространен в природе, например, в биогазе и природном газе.
Аммиак (NH3) состоит из атома азота, связанного с тремя атомами водорода. Он имеет острый запах и широко используется в промышленности для получения удобрений, а также в качестве растворителя и вещества, участвующего в химических реакциях.
Таким образом, метан и аммиак отличаются друг от друга по строению, а их простые формулы указывают на эту разницу.
Расположение атомов в молекуле метана и аммиака
Аммиак (NH3) - это высоко растворимая в воде и очень едкая жидкость. В молекуле аммиака атом азота располагается в центре. Вокруг атома азота находятся три атома водорода. Отличительной чертой расположения атомов в молекуле аммиака является формирование пирамидальной структуры с атомом азота в вершине пирамиды. Данное расположение атомов делает молекулу аммиака полярной и вызывает противоположные электрические заряды в разных частях молекулы.
Тип связей между атомами в метане и аммиаке
Метан (CH4) и аммиак (NH3) отличаются по строению из-за различия в типе связей между атомами.
В метане каждый из четырех атомов водорода образует одну σ-связь с атомом углерода. Эти связи являются неполярными и симметричными, поскольку оба атома имеют одинаковую электроотрицательность. За счет насыщения валентных электронных оболочек атомы образуют тетраэдрическую структуру, где четыре связи и четыре электронных пары вокруг углерода равноудалены друг от друга.
В аммиаке главная центральная часть молекулы - атом азота - образует три σ-связи с атомами водорода. При этом атом азота обладает одной свободной электронной парой. В отличие от метана, аммиак имеет полный пирамидальный вид в трехмерном пространстве. Связь между атомом азота и каждым атомом водорода электронегативнее и более полярна, что создает положительный полюс на атоме водорода и отрицательный полюс на азоте.
Геометрическая форма молекулы метана и аммиака
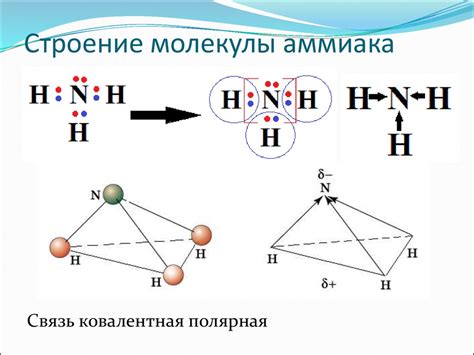
Молекула аммиака (NH3) имеет пирамидальную форму. В ней атом азота находится в вершине пирамиды, а три атома водорода располагаются вокруг него на определенном расстоянии. Углы между атомами водорода и азотом примерно равны 107 градусам.
Геометрическая форма молекулы метана и аммиака объясняется взаимодействием электронных облаков атомов и пространственной ориентацией связей между атомами в молекуле. Такая конфигурация является стабильной и обуславливает основные химические и физические свойства метана и аммиака.
Полярность молекулы метана и аммиака
Молекула метана представляет собой тетраэдральную структуру, в которой четыре атома водорода равномерно расположены вокруг атома углерода. Эта молекула является неполярной, поскольку все атомы имеют одинаковую электроотрицательность и связи между ними симметрично расположены. Таким образом, взаимодействие с полярными молекулами у метана является слабым.
С другой стороны, молекула аммиака имеет пирамидальную форму, с атомом азота в центре и тремя атомами водорода, образующими пирамидальную ориентацию вокруг него. В этом случае, электроотрицательность азота выше, чем у водорода, и связи между азотом и водородом являются полярными. Это делает молекулу аммиака полярной и более сильно взаимодействующей с другими полярными молекулами.
| Молекула | Строение | Полярность |
|---|---|---|
| Метан | Тетраэдральная | Неполярная |
| Аммиак | Пирамидальная | Полярная |
Таким образом, различие в строении молекулы метана и аммиака приводит к различной полярности этих соединений. Метан является неполярным и слабо взаимодействует с полярными молекулами, в то время как аммиак, благодаря своей полярной структуре, проявляет сильные взаимодействия с полярными соединениями.
Физические свойства метана и аммиака

Метан:
| Физическое свойство | Значение |
| Молекулярная масса | 16,04 г/моль |
| Температура кипения | -161,5 °C |
| Температура плавления | -182,5 °C |
| Плотность | 0,656 г/л (при 0 °C и 1 атм) |
| Растворимость в воде | практически нерастворим |
Аммиак:
| Физическое свойство | Значение |
| Молекулярная масса | 17,03 г/моль |
| Температура кипения | -33,34 °C |
| Температура плавления | -77,73 °C |
| Плотность | 0,771 г/л (при 0 °C и 1 атм) |
| Растворимость в воде | 1000 г/л (при 25 °C) |
Таким образом, метан и аммиак имеют значительные различия в своих физических свойствах, таких как температура кипения и плавления, плотность и растворимость в воде.




