Равновесие химической реакции - это состояние, когда скорость протекания прямой реакции равна скорости обратной реакции, и концентрации реагирующих веществ остаются постоянными. Это состояние можно изменить путем изменения концентраций реагентов или при добавлении различных веществ.
Один из способов изменить равновесие реакции - это добавление щелочи. Щелочи, такие как гидроксид натрия или гидроксид калия, являются основаниями и химически реагируют с кислотами. Когда щелочь добавляется к реакции, она вступает в реакцию с существующими кислотами, образуя соль и воду.
При добавлении щелочи к реакции, равновесие смещается в сторону уменьшения концентрации кислоты и увеличения концентрации ее соли. Это происходит потому, что ион гидроксида из щелочи приводит к уменьшению концентрации иона водорода (он является кислотным), что, в свою очередь, смещает равновесие в сторону образования ионов водорода и ионов гидроксида.
Влияние добавления щелочи на смещение равновесия

Добавление щелочи в реакцию может привести к смещению равновесия в разные стороны в зависимости от типа реакции и величины добавленной щелочи.
Если реакция является кислотно-щелочной нейтрализацией, то при добавлении щелочи смещение равновесия будет происходить в сторону образования большего количества продукта. Таким образом, добавление щелочи приведет к увеличению концентрации продукта реакции и уменьшению концентрации исходных реагентов.
В случае гидролиза солей, при добавлении щелочи может происходить смещение равновесия в сторону увеличения концентрации ионов гидроксила. Это происходит из-за ионизации воды и образования гидроксида, что приводит к смещению равновесия в сторону щелочной части реакции.
Однако, в некоторых реакциях добавление щелочи может привести к обратному эффекту. Например, в реакции гидратации альдегида или кетона, добавление щелочи может привести к образованию иона гидроксида, который будет соединяться с карбонильной группой, образуя гемиформу и приводя к смещению равновесия в сторону реагентов.
Таким образом, влияние добавления щелочи на смещение равновесия зависит от типа реакции и конкретных условий, и может привести как к смещению в сторону продуктов, так и в сторону исходных реагентов.
| Тип реакции | Влияние добавления щелочи на смещение равновесия |
|---|---|
| Кислотно-щелочная нейтрализация | Смещение в сторону продуктов |
| Гидролиз солей | Смещение в сторону гидроксида |
| Гидратация альдегида или кетона | Может привести как к смещению в сторону продуктов, так и в сторону реагентов |
Что происходит при добавлении щелочи?
OH- + H+ → H2O
Таким образом, при добавлении щелочи, происходит удаление протонов из среды, что приводит к снижению концентрации протонов и увеличению pH. Также, изменение pH влияет на комплексообразование и диссоциацию веществ, что может изменить равновесие химической реакции.
В реакциях, где входит восстановление или окисление, добавление щелочи может привести к снижению степени окисления или восстановления соответственно. Это связано с изменением концентрации реагентов и продуктов реакции.
Также, при добавлении щелочи может происходить изменение растворимости солей. Щелочь может растворить соли, образуя ионы, которые могут влиять на образование осадков или их растворение.
Изменение ионизации вещества при внесении щелочи
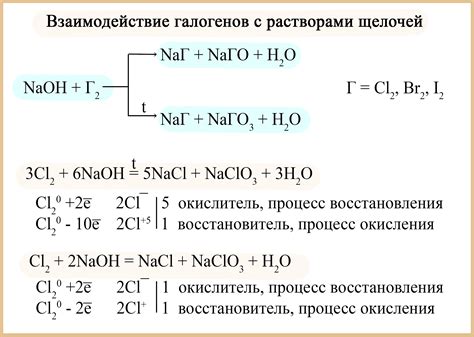
Ионизация вещества происходит путем отрыва или присоединения электронов от или к атомам. В случае внесения щелочи, этот процесс происходит за счет реакций диссоциации и гидролиза.
Диссоциация – это процесс распада вещества на ионы в растворе. При добавлении щелочи, гидроксиды распадаются на ионы гидроксида и соответствующие катионы металла. Например, гидроксид натрия (NaOH) диссоциирует на ионы Na+ и OH-.
Гидролиз – это процесс, при котором ионы раствора реагируют с водой, образуя новые соединения. Он происходит, когда катионы или анионы образуют слабые кислоты или основания. При добавлении щелочи, гидроксиды проявляют свои основные свойства и гидролизируются. Например, ион гидроксида (OH-) гидролизирует и совместно с ионами металла может образовывать гидроксокомплексы.
Таким образом, внесение щелочи в вещество приводит к значительному повышению ионизации вещества. Это может привести к изменению его физических и химических свойств, таких как растворимость, кислотность или основность. Также важно учитывать, что процесс ионизации вещества при внесении щелочи может повлиять на другие реакции и процессы, которые могут происходить в системе.
Возможность обратной реакции при добавлении щелочи
При добавлении щелочи в систему, в которой происходит химическая реакция, происходит смещение равновесия в сторону увеличения концентрации продуктов. Однако, в некоторых реакциях, возможна и обратная реакция, когда продукты реакции реагируют с добавленной щелочью и образуют исходные реагенты.
Обратная реакция может происходить из-за наличия в системе запаса реагентов или из-за удаления продуктов реакции. В таких случаях, при добавлении щелочи, равновесие может сместиться в сторону увеличения концентрации реагентов, и обратная реакция начнется.
Возможность обратной реакции при добавлении щелочи может быть важным фактором при определении направления химической реакции и влияет на ее равновесные условия. Это связано с тем, что обратная реакция может привести к изменению концентраций реагентов и продуктов, а следовательно, и к изменению равновесной константы реакции.
Понимание возможности обратной реакции при добавлении щелочи в систему является важным для практических применений в химической промышленности и лабораторных исследованиях. Учет этого явления позволяет более точно прогнозировать результаты химических реакций и оптимизировать процессы.
Роль щелочи в реакционной среде
Во-первых, щелочи могут выступать как катализаторы реакций, ускоряя их скорость. Они действуют путем разрыва связей в реагентах и образования новых связей между продуктами. Это позволяет реакциям протекать быстрее и более эффективно.
Во-вторых, щелочи могут изменять pH реакционной среды. pH - это показатель концентрации водородных ионов. Когда щелочь добавляется в реакционную среду, она поглощает водородные ионы и повышает их концентрацию. Это может привести к смещению равновесия в сторону продуктов или реагентов, в зависимости от химической реакции.
Кроме того, щелочи могут оказывать влияние на растворимость солей и образование осадков. Они могут увеличивать или уменьшать растворимость определенных веществ в зависимости от их химических свойств. Это может существенно влиять на химические реакции и образование продуктов.
Таким образом, щелочи играют важную роль в реакционной среде. Они способны влиять на скорость, направление и эффективность химических реакций, а также на свойства солей и осадков, образующихся в результате этих реакций.
Уравновешивание добавлением щелочи
Добавление щелочи в раствор может существенно изменить равновесие химической реакции. Щелочь, как сильное основание, способна принимать протоны и увеличивать концентрацию гидроксидных ионов (OH-) в растворе. Это приводит к изменению pH раствора и смещению равновесия в сторону образования или распада кислотных форм.
Конкретное направление смещения равновесия будет зависеть от специфики химической реакции. Некоторые реакции проявляют кислотные свойства или вовлекают кислотные формы в дальнейшую реакцию. В данном случае, добавление щелочи увеличивает концентрацию гидроксидных ионов и смещает равновесие в сторону кислотных форм, чтобы компенсировать большее количество гидроксидных ионов.
Однако, для других химических реакций добавление щелочи может привести к обратному эффекту. Например, в реакции образования оснований, добавление щелочи может уменьшить концентрацию гидроксидных ионов и сместить равновесие в сторону кислотных форм, чтобы уравновесить концентрации основных и кислотных форм.
Важно понимать, что равновесие в химической реакции зависит от концентрации реагентов и продуктов. Добавление щелочи может изменить концентрации ионов, что в свою очередь вызовет смещение равновесия. Точное направление смещения равновесия определяется химическими свойствами реагентов и конкретной реакцией.
Регулирование pH при помощи щелочей

Добавление щелочей в кислую среду позволяет нейтрализовать избыток кислоты и повысить pH. Это особенно важно в биологических системах, где поддержание оптимального pH является критическим условием для нормального функционирования.
Когда щелочи добавляются в кислотную среду, гидроксидные ионы (OH-) выполняют функцию базы и принимают протоны от кислотных ионов (H+), образуя молекулы воды (H2O). Этот процесс называется нейтрализацией и позволяет достичь более нейтрального pH.
Однако при добавлении щелочей необходимо учитывать их концентрацию и реактивность, так как слишком большое количество щелочей может привести к избыточной щелочности и повышенному pH. В таких случаях, дальнейшее добавление щелочей может вызвать обратную реакцию и смещение равновесия в сторону образования кислотных ионов.
Регулирование pH при помощи щелочей является важным инструментом в различных областях науки и промышленности. Благодаря этому процессу можно поддерживать оптимальные условия для реакций, происходящих в различных системах, а также предотвращать разрушение и нарушение баланса биологических систем.




