Атомы состоят из ядра и облака электронов, которые обращаются вокруг него на разных энергетических уровнях. Важной характеристикой атомов является количество электронов на их внешнем энергетическом уровне. Это количество определяет, как атомы взаимодействуют друг с другом и какие химические связи они могут образовывать.
Распределение электронов в атоме следует определенным правилам, которые основаны на принципе заполнения энергетических уровней в порядке возрастания их энергии. Правила заполнения электронных уровней помогают определить количество электронов на внешнем энергетическом уровне.
Чтобы определить количество электронов на внешнем энергетическом уровне, необходимо узнать электронную конфигурацию атома. Электронная конфигурация показывает, сколько электронов находится на каждом энергетическом уровне. Для этого можно использовать таблицу Менделеева, в которой указано количество электронов на каждом энергетическом уровне для всех элементов.
Значение количества электронов
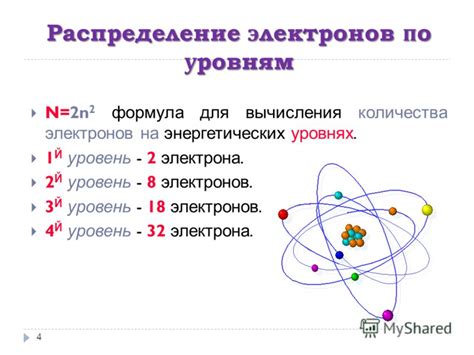
Количество электронов на внешнем уровне атома оказывает значительное влияние на его свойства и химическую активность. Внешний энергетический уровень атома, называемый валентным, содержит электроны, которые определяют его взаимодействие с другими атомами.
Число электронов на внешнем уровне атома зависит от его порядкового номера в периодической системе элементов. В основном, атомы стремятся заполнить свой внешний энергетический уровень полностью, чтобы достичь наиболее стабильного состояния – октаэдрической конфигурации, в которой на этом уровне находится 8 электронов. Однако, есть и исключения.
Например, атомы галогенов (группа 17 периодической системы) имеют 7 электронов на внешнем уровне. Они стремятся получить еще один электрон, чтобы заполнить внешний уровень до 8 электронов и достичь стабильности. В свою очередь, щелочноземельные металлы (группа 2) имеют 2 электрона на внешнем уровне и желают отдать эти электроны для достижения стабильности.
Таким образом, количество электронов на внешнем уровне атома определяет его реактивность и способность образовывать химические связи с другими атомами. Это является основным фактором, который определяет химические свойства элементов и их поведение в химических реакциях.
Внешний уровень электронов
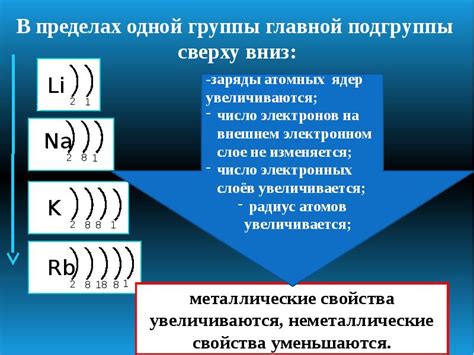
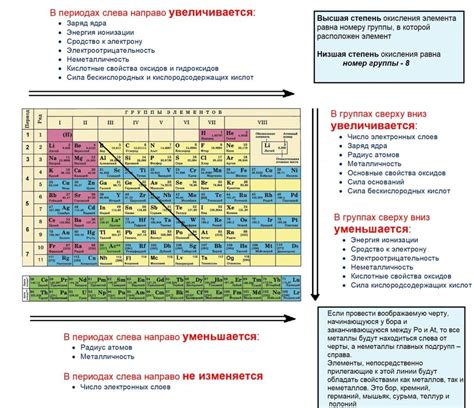
Количество электронов на внешнем уровне в атоме определяется по номеру группы в таблице Менделеева. Номер группы указывает на количество электронов на внешнем уровне. Например, для элементов группы 1 на внешнем уровне находится 1 электрон, для элементов группы 2 - 2 электрона, и так далее.
Внешний уровень электронов имеет большое значение для химических свойств атома. Электроны на внешнем уровне участвуют в химических реакциях и определяют, какие элементы могут образовывать химические связи между собой. Также количество электронов на внешнем уровне определяет химическую активность элемента: элементы с одинаковым количеством электронов на внешнем уровне обладают схожими свойствами.
| Группа | Количество электронов на внешнем уровне |
|---|---|
| 1 | 1 |
| 2 | 2 |
| 3-12 | от 1 до 10 |
| 13 | 3 |
| 14 | 4 |
| 15 | 5 |
| 16 | 6 |
| 17 | 7 |
| 18 | 8 |
Атом и химические связи
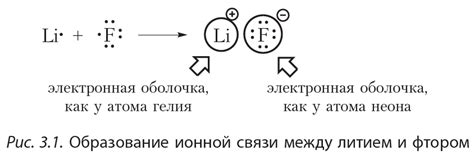
Количество электронов на внешнем уровне атома определяет его химические свойства и возможность образования химических связей. В зависимости от количества электронов на внешнем уровне атомы делятся на восьмеричные и не восьмеричные.
Восьмеричные атомы обладают стабильной электронной конфигурацией, при которой внешний уровень содержит 8 электронов. Они стремятся заполнить внешний уровень таким образом, чтобы количество электронов достигло восьми. Это достигается путем обмена, передачи или совместного использования электронов с другими атомами.
Не восьмеричные атомы имеют на внешнем уровне меньше или больше 8 электронов. Чтобы достичь стабильной конфигурации, они могут образовывать более сложные химические связи, в том числе тройные и двойные связи.
Химические связи между атомами возникают вследствие взаимодействия и обмена электронами. Они определяют свойства вещества и его возможности к реакциям с другими веществами. Химические связи могут быть ковалентными, ионными или металлическими.
Ковалентные связи образуются при совместном использовании электронов двумя атомами. В этих связях электроны обоих атомов находятся в общей электронной оболочке. Ионные связи возникают между атомами, когда один атом отдает электроны, а другой атом их принимает. Металлические связи характерны для металлов, где электроны внешней оболочки делятся между атомами и образуют «электронное море».
Понимание структуры атома и химических связей позволяет увидеть, какие реакции могут происходить между атомами и какие соединения они могут образовывать. Это является основой для понимания химических процессов и изучения химии в целом.
| Тип связи | Описание |
|---|---|
| Ковалентная связь | Взаимодействие атомов через совместно используемые электроны |
| Ионная связь | Образование связи путем передачи электронов от одного атома к другому |
| Металлическая связь | Образование связи путем обмена электронами между атомами металлов |
Внешний электрон и свойства элемента
Количество внешних электронов может быть различным у разных элементов. Например, у алкалийных металлов внешний электрон один, у щелочноземельных металлов - два, у кислорода - шесть, а у хлора - семь. Количество внешних электронов можно определить по номеру группы элемента в таблице Менделеева.
Свойства элементов, имеющих одинаковое количество внешних электронов, часто сходны. Например, все элементы одной группы редкоземельных металлов имеют два внешних электрона и обладают схожими химическими свойствами. Это обусловлено тем, что внешние электроны находятся на одном и том же энергетическом уровне и обладают схожими распределениями электронной плотности и энергии.
Таким образом, внешний электрон играет важную роль в определении химических свойств элемента и его способности образовывать соединения с другими элементами.
Определение количества электронов на внешнем уровне
Количество электронов на внешнем уровне в атоме можно определить с помощью периодической таблицы элементов. В периодической таблице элементы расположены по возрастанию атомного номера, что позволяет легко определить количество электронов на внешнем уровне для данного элемента.
Для определения количества электронов на внешнем уровне нужно найти атомный номер элемента в периодической таблице и посмотреть на его электронную конфигурацию. Электронная конфигурация представляет собой запись, которая показывает распределение электронов по энергетическим уровням и подуровням.
На внешнем уровне находятся электроны, расположенные на самом последнем энергетическом уровне элемента. Например, для элемента литий (Li) с атомным номером 3, электронная конфигурация будет 2,1. Это означает, что на внешнем уровне находится 1 электрон.
Обратите внимание, что на внешнем уровне может находиться несколько электронов. Например, для элемента кислород (O) с атомным номером 8, электронная конфигурация будет 2,6. Это означает, что на внешнем уровне находится 6 электронов.
Попробуйте применить этот метод к другим элементам из периодической таблицы, чтобы определить количество электронов на их внешнем уровне.
Периодическая таблица элементов
В таблице элементы разделены на строки, которые называются периодами, и столбцы, которые называются группами. Каждый элемент обозначается символом, например, H для водорода или O для кислорода, и имеет соответствующий атомный номер.
Периодическая таблица помогает установить закономерности в химических свойствах элементов и предсказывать их поведение в химических реакциях. Она также помогает определить количество электронов на внешнем уровне атома, что является важным показателем для понимания его химической активности и возможности образования соединений.
В таблице элементы разделены на блоки: s-блок, p-блок, d-блок и f-блок. Каждый блок содержит элементы с определенными энергетическими уровнями (s, p, d, f) и особыми химическими свойствами. Например, элементы s-блока имеют одну или две электронные оболочки на внешнем уровне, а элементы p-блока имеют от трех до восьми электронов на внешнем уровне.
Знание расположения элементов в периодической таблице и их электронной конфигурации позволяет быстро определить количество электронов на внешнем уровне и, таким образом, легко предсказать химические свойства и реактивность атомов.
Важно: Периодическая таблица элементов является основой для изучения химии и имеет большое значение для понимания физических и химических процессов в мире вокруг нас.
Электронная конфигурация атома
Электронная конфигурация атома представляет собой упорядоченное распределение электронов по энергетическим уровням и подуровням в атоме.
Каждому атому соответствует своя уникальная электронная конфигурация, которая определяет его химические свойства и поведение в химических реакциях. Электронная конфигурация включает информацию о количестве электронов на каждом энергетическом уровне и подуровне.
Правила заполнения электронных уровней и подуровней атома определены принципами и правилами, такими как принцип уровня энергии, принцип Паули и правило Гунда. Согласно этим правилам, электроны заполняют энергетические уровни и подуровни, начиная с самого низкого энергетического уровня.
Электронная конфигурация атома представляется в виде последовательности чисел и символов, где числа указывают на количество электронов на каждом энергетическом уровне, а символы указывают на названия подуровней, на которых находятся эти электроны.
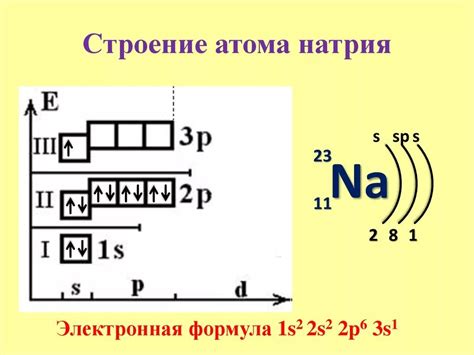
Например, электронная конфигурация атома кислорода (O):
1s2 2s2 2p4
Здесь "1s2" означает, что на первом энергетическом уровне находятся 2 электрона на 1s-подуровне. "2s2" означает, что на втором энергетическом уровне находятся 2 электрона на 2s-подуровне, а "2p4" означает, что на втором энергетическом уровне находятся 4 электрона на 2p-подуровне.
Зная электронную конфигурацию атома, можно предсказать его химическое поведение и установить связи с другими атомами для образования химических соединений.
Ионизационная энергия и электроотрицательность
Электроотрицательность - это способность атома притягивать электроны к себе в рамках химической связи. Величина электроотрицательности также зависит от положения элемента в периодической системе. Чем выше электроотрицательность, тем сильнее атом притягивает электроны и образуется поляризованная химическая связь.
Связь между ионизационной энергией и электроотрицательностью заключается в том, что атомы с большей электроотрицательностью обычно имеют более высокую ионизационную энергию. Это связано с тем, что такие атомы очень сильно притягивают свои электроны и поэтому они труднее удалить.
Знание значений ионизационной энергии и электроотрицательности элементов позволяет определить количество электронов на внешнем уровне атома и его химические свойства. Оно также является важным для понимания процессов, происходящих в химических реакциях и образования соединений.
Саженцевые свойства элементов
Количество электронов на внешнем уровне определяет их валентность и способность к образованию химических связей. Валентные электроны на внешнем уровне атома могут участвовать в образовании химических связей с другими атомами, образуя ионы или молекулы. Количество валентных электронов может также определять химические реакции и свойства данного элемента.
Практическое применение информации о внешних электронах
Знание количества электронов на внешнем уровне в атоме имеет большое значение в различных областях науки и технологии:
- Химия: Количество электронов на внешнем уровне атома прямо влияет на его химические свойства и способность вступать в химические реакции. Зная количество внешних электронов, можно предсказать, с какими элементами атом может образовывать химические связи и какие соединения он может образовывать.
- Физика: Понимание внешних электронов помогает в изучении элементарных частиц, атомной и молекулярной физики. Свойства материалов и способы их использования тесно связаны с поведением электронов на внешних уровнях.
- Материаловедение: Определенное количество внешних электронов влияет на электрические, магнитные и тепловые свойства материалов. Зная количество электронов на внешних уровнях, можно создавать материалы с нужными свойствами для различных применений.
- Электроника и технология: Знание числа внешних электронов помогает разрабатывать и проектировать устройства, полупроводники и схемы, используемые в различных электронных устройствах. Отношение к внешним электронам обуславливает такие свойства, как проводимость электричества или света.
Информация о внешних электронах в атоме играет важную роль в различных научных и промышленных отраслях и позволяет создавать новые материалы, разрабатывать эффективные технологии и улучшать существующие процессы.
- Использование периодической таблицы элементов может помочь в определении количества электронов на внешнем уровне. Номер группы элемента соответствует количеству электронов на его внешнем уровне.
- Альтернативным методом определения количества электронов на внешнем уровне является расчет электронной конфигурации атома с помощью формул и правил, которые основаны на расположении электронов в энергетических уровнях.
- Проведение химических экспериментов, таких как анализ реакций атомов в соединениях, позволяет определить количества электронов на внешнем уровне для данного атома.
- Для уверенного определения количества электронов на внешнем уровне рекомендуется использовать комбинацию различных методов и не ограничиваться только одним из них.
Использование указанных методов и рекомендаций позволит более точно определить количество электронов на внешнем уровне в атоме и применять эту информацию в различных химических исследованиях и приложениях.




