В основе всех физических и химических процессов лежит взаимодействие молекул. Эти невидимые для человеческого глаза структуры образуют все вещества вокруг нас. Однако, иногда молекулы могут стать заметнее и проявить свои свойства в виде отдельных физических явлений.
Заметность молекул обусловлена их количественным увеличением или изменением условий окружающей среды. Например, при повышении температуры или давления молекулы начинают демонстрировать новые свойства, которые не были заметны при обычных условиях.
Молекулы взаимодействуют между собой через различные силы, такие как ван-дер-ваальсовы силы, ионо-дипольные силы, водородные связи и т.д. Эти силы могут существенно влиять на свойства вещества и, соответственно, на его заметность.
Ван-дер-ваальсовы силы являются наиболее слабыми и действуют между нейтральными молекулами. Они возникают из-за временно изменяющихся моментов заряда в молекулах и обуславливают такие явления как адгезия и когезия вещества.
Как молекулы обмениваются энергией, производят электричество и излучают свет
Молекулы, состоящие из атомов, обладают потенциальной энергией, которая может быть переведена в другие формы энергии. Обмен энергией между молекулами происходит за счет различных процессов, таких как колебания, вращения и электронные переходы.
Одна из форм обмена энергией между молекулами - это процесс производства электричества. Некоторые молекулы способны преобразовывать энергию света, тепла или химической энергии в электрическую энергию. Это основа работы фотоэлектрических элементов, таких как солнечные батареи. Когда свет падает на фоточувствительную молекулу, электроны внутри молекулы получают энергию и переносятся на более высокий энергетический уровень, создавая силу тока.
Некоторые молекулы также способны излучать свет. Когда энергия достаточно высока, молекула может поглощать эту энергию и перейти на более высокий энергетический уровень. Однако, она не может долго находиться в этом состоянии и возвращается на нижний энергетический уровень, излучая фотон света. Процесс излучения света в разных молекулах приводит к разнообразию цветов и явлений света, таких как люминесценция и фосфоресценция.
Обмен энергией между молекулами является важным механизмом, позволяющим создавать электричество и освещать нашу жизнь разнообразием цветов и светящимися явлениями.
Взаимодействие молекул в химических реакциях
Молекулы, состоящие из атомов, могут вступать во взаимодействие друг с другом при проведении химических реакций. Во время химической реакции происходят изменения внутреннего строения молекул, что приводит к образованию новых веществ.
В химических реакциях молекулы могут взаимодействовать различными способами:
- Обмен электронами. Молекулы обмениваются электронами, что в результате приводит к образованию новых связей.
- Образование новых связей. Молекулы могут объединяться для образования новых химических соединений, при этом происходит образование новых связей между атомами.
- Разрыв связей. Во время химической реакции некоторые связи между атомами могут быть разорваны, что приводит к образованию новых веществ.
- Обмен атомами. Во время реакции атомы одних молекул могут перемещаться в другие молекулы, что приводит к образованию новых соединений.
Взаимодействие молекул в химических реакциях контролируется различными факторами, такими как температура, концентрация веществ, наличие катализаторов. Эти факторы влияют на скорость реакции и ее направленность.
Изучение взаимодействия молекул в химических реакциях позволяет понять, как образуются и протекают химические реакции, а также разработать новые методы синтеза и модификации веществ.
Физические силы, обуславливающие взаимодействие молекул
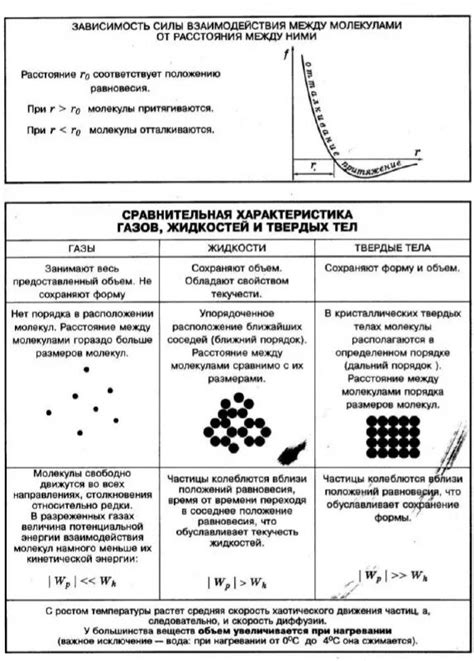
Молекулы, составляющие вещества в природе, взаимодействуют между собой благодаря физическим силам. Эти силы играют важную роль в определении свойств веществ и их поведении.
Ван-дер-ваальсовы силы – один из основных механизмов взаимодействия молекул. Эти силы обусловлены временными диполями, возникающими в молекулах вследствие неравномерного распределения электронной оболочки. В моменты, когда в молекуле дипольных моментов нет, молекула является неполярной, но диполи могут временно возникать благодаря флуктуациям электронной оболочки. Это создает разность электрических зарядов внутри молекулы, что привлекает соседние молекулы. Ван-дер-ваальсовы силы являются слабыми, но они суммируются и оказывают влияние на макроскопическое поведение веществ.
Электростатические силы – силы, возникающие между заряженными молекулами. Молекулы могут быть заряжеными благодаря активным группировкам атомов или молекул, которые могут сконцентрировать или перераспределить электроны. Электростатические силы сильнее, чем ван-дер-ваальсовы силы, и они могут быть как притягивающими, так и отталкивающими.
Ковалентные связи – форма взаимодействия, при которой атомы обменивают электроны, образуя молекулу. Это самая сильная форма связей между атомами, и они обычно формируются между атомами одного или разных элементов. В ковалентных связях электроны между атомами общие, что создает устойчивость и прочность связи.
Дисперсионные силы – силы, обусловленные мгновенными диполями, возникающими из-за флуктуаций зарядов в электронной оболочке молекулы. Дисперсионные силы сильно зависят от размера и формы молекулы. Чем больше разница в электронных оболочках между атомами, тем сильнее дисперсионные силы.
Взаимодействие между молекулами определяется, в первую очередь, типом сил, которые действуют между ними. Понимание этих механизмов позволяет нам понять основные физические принципы, лежащие в основе поведения веществ и их свойств.
Теплообмен и передача энергии между молекулами
Когда молекулы вещества становятся заметнее, возникает вопрос о том, каким образом происходит теплообмен между ними и как передается энергия.
Одним из основных механизмов теплообмена между молекулами является кондукция. Когда молекулы находятся вблизи друг друга, они могут обмениваться энергией путем столкновений. При столкновении одна молекула может передать свою энергию другой молекуле, что приводит к повышению ее энергетического состояния. Таким образом, происходит теплообмен между молекулами.
Кроме того, теплообмен между молекулами может происходить с помощью излучения. Когда молекулы обладают энергией выше некоторого порога, они начинают излучать энергию в форме электромагнитных волн. Такое излучение, называемое тепловым излучением, может быть поглощено другими молекулами, в результате чего происходит передача энергии.
Дополнительно, теплообмен между молекулами может происходить с помощью конвекции. Когда молекулы двигаются внутри среды, они могут переносить с собой тепло и передавать его другим молекулам. Например, при нагревании воздуха возникают конвекционные токи, которые перемещают теплые молекулы от источника нагрева к более холодным областям.
Таким образом, теплообмен и передача энергии между молекулами происходят за счет кондукции, излучения и конвекции. Эти процессы играют важную роль в регуляции теплообмена в различных системах и позволяют молекулам взаимодействовать и обмениваться энергией друг с другом.
Основы молекулярного движения и свободные радикалы
В процессе движения молекулы могут образовывать связи друг с другом, образуя свободные радикалы. Они являются нестабильными молекулярными частицами, которые имеют незаполненную электронную оболочку. Их химическая активность выражается в их способности образовывать новые химические соединения путем реакции с другими молекулами.
Свободные радикалы могут образовываться при различных процессах, таких как окисление, радиационное воздействие и тепловой стресс. Они являются основными участниками цепных реакций, так как способны инициировать и поддерживать эти реакции. Кроме того, свободные радикалы могут участвовать в различных физиологических и патологических процессах в организме.
Основные свойства свободных радикалов включают их высокую активность и кратковременную жизнь. Это связано с тем, что у них нет объединенной энергетической оболочки, что делает их очень реактивными. Для стабилизации свободных радикалов организм производит антиоксиданты - вещества, способные нейтрализовать эти радикалы и предотвратить их негативные воздействия на организм.
- Межмолекулярные силы:
- Электростатические силы;
- Ван-дер-ваальсовы силы;
- Диполь-дипольные силы;
- Силы водородных связей.
- Свободные радикалы:
- Нестабильные молекулярные частицы;
- Незаполненная электронная оболочка;
- Химическая активность;
- Участие в цепных реакциях;
- Участие в физиологических и патологических процессах;
- Высокая активность и кратковременная жизнь;
- Производство антиоксидантов для нейтрализации радикалов.
Молекулярная структура и взаимодействие веществ
Молекулярная структура вещества определяет его свойства и способность к взаимодействию с другими молекулами. Молекулы состоят из атомов, которые связаны химическими связями. Тип связи и геометрия молекулы влияют на ее взаимодействие с другими молекулами.
Существует несколько типов межмолекулярного взаимодействия, таких как дисперсное взаимодействие (взаимодействие между неполярными молекулами), диполь-дипольное взаимодействие (взаимодействие между полярными молекулами), а также водородные связи, ионно-дипольное взаимодействие и ван-дер-ваальсовы взаимодействия.
Одним из наиболее известных межмолекулярных взаимодействий является водородная связь, которая играет ключевую роль во многих биологических процессах и химических реакциях. Водородные связи происходят между атомами водорода и элементами с высокой электроотрицательностью, такими как кислород и азот.
Другим примером межмолекулярного взаимодействия является дисперсное взаимодействие, которое происходит между неполярными молекулами. Оно объясняет свойства газов и жидкостей, такие как их температура кипения и плотность.
Взаимодействие между молекулами имеет огромное значение в химии и физике. Оно определяет физические и химические свойства вещества и позволяет понять его поведение в различных условиях. Изучение молекулярной структуры и взаимодействия между молекулами помогает улучшить наши знания о мириадах веществ, которые окружают нас.
| Тип взаимодействия | Описание |
|---|---|
| Дисперсное взаимодействие | Происходит между неполярными молекулами и определяет их физические свойства |
| Диполь-дипольное взаимодействие | Происходит между полярными молекулами и влияет на их химическую активность |
| Водородные связи | Взаимодействие между атомами водорода и элементами с высокой электроотрицательностью |
| Ионно-дипольное взаимодействие | Взаимодействие между ионами и полярными молекулами |
| Ван-дер-ваальсовы взаимодействия | Происходят между атомами и молекулами и зависят от их размера и формы |
Излучение света при взаимодействии молекул

Молекулы способны взаимодействовать друг с другом, обмениваясь энергией. Одним из результатов такого взаимодействия может быть излучение света. Когда молекула поглощает энергию, ее электроны возбуждаются и переходят на более высокие энергетические уровни. Затем, эти электроны возвращаются на исходные уровни, испуская энергию в виде света.
Излучение света при взаимодействии молекул имеет свои особенности. Во-первых, цвет света, который испускает молекула, зависит от энергетического уровня, на котором находится возбужденный электрон. Чем больше энергия, тем короче длина волны света.
Во-вторых, молекулы могут взаимодействовать друг с другом таким образом, что энергия, полученная от одной молекулы, может быть передана другой молекуле. Это позволяет молекулам передавать энергию на большие расстояния и вызывать цепную реакцию излучения света.
Излучение света при взаимодействии молекул имеет широкие применения. Оно используется в различных областях науки и техники, включая фотохимию, фотоэлектронику, оптику и лазерную технологию. Кроме того, изучение этого явления позволяет лучше понять структуру молекул и их свойства.
| Преимущества излучения света при взаимодействии молекул: |
|---|
| - Дает возможность исследовать структуру и свойства молекул; |
| - Позволяет передавать энергию на большие расстояния; |
| - Имеет широкие применения в науке и технике. |




