Химические реакции великолепно демонстрируют, как энергия может быть обменена и преобразована. Одним из самых важных аспектов химических реакций является их тепловой эффект - изменение теплоты, связанное с процессом. Классификация химических реакций по тепловому эффекту позволяет нам лучше понять энергетические изменения, происходящие во время реакции.
Тепловой эффект может быть либо поглощаемым (эндотермическим), либо выделяющимся (экзотермическим). В эндотермической реакции система поглощает энергию из окружающей среды, и температура окружающей среды снижается. В экзотермической реакции система, наоборот, выделяет энергию, и температура окружающей среды повышается.
Примером реакции с эндотермическим тепловым эффектом является реакция аммиака с кислородом для образования азотной кислоты и воды. В данной реакции энергия поглощается, и окружающая среда охлаждается. С другой стороны, реакция горения метана с кислородом является примером экзотермической реакции. В этом процессе выделяется энергия в виде тепла и света, и окружающая среда нагревается. Тепловой эффект обеих реакций может быть измерен и использован для определения энергетической эффективности данных процессов.
Эндотермические реакции: потребление энергии при протекании

Поглощение энергии в эндотермических реакциях может быть вызвано различными причинами, такими как распад химических связей, преобразование твердых веществ в газы, испарение жидкостей и т.д. В результате этого процесса в окружающем пространстве наблюдается охлаждение, так как энергия передается от системы реакции к окружающей среде.
Примерами эндотермических реакций могут служить:
- Восстановление металлов из их оксидов. При нагревании оксида металла термической энергией происходит реакция, в результате которой образуется металл и выделяется тепло. Примером такой реакции может служить восстановление оксида железа водородом:
- Fe2O3 + 3H2 → 2Fe + 3H2O
- NH4Cl + NH3 → NH4+ + Cl- + NH3
В эндотермических реакциях энергия может быть поглощена из окружающей среды, электрического источника, а также из других источников энергии. Такие реакции важны для многих жизненных процессов, в том числе для поглощения тепла в химических системах и регулирования температуры.
Экзотермические реакции: выделение энергии при протекании
Выделение энергии при экзотермических реакциях осуществляется в виде теплового излучения или передается окружающей среде в форме тепла. В результате этого процесса температура окружающей среды повышается, что можно ощутить на ощупь или зафиксировать при помощи термометра.
Примеры экзотермических реакций:
- Горение бумаги или дерева. Во время горения осуществляется окислительно-восстановительная реакция, при которой выделяется большое количество тепла.
- Процесс реагирования соды с уксусом. При смешивании соды и уксуса происходит реакция, при которой выделяется тепло. Этот процесс можно наблюдать появлением пузырьков и потеплением раствора.
- Кислотно-щелочные реакции. Многие кислоты и щелочи образуют экзотермические реакции при взаимодействии. При этом с выделением энергии образуется вода и соль.
Экзотермические реакции находят широкое применение в различных областях науки и техники. Их использование позволяет получать энергию и приводить в движение различные устройства, а также использовать в качестве источника тепла для обогрева и других бытовых нужд.
Автотермические реакции: нейтральный тепловой эффект при протекании

В автотермических реакциях энергия, выделяющаяся или поглощаемая в процессе, не используется для изменения температуры системы, а направляется на выполнение химических изменений. Такие реакции обеспечивают равновесный тепловой эффект, который называется нейтральным тепловым эффектом.
Примером автотермической реакции является горение угля, при котором происходит окисление углерода и выделяется большое количество теплоты. При этом полученная энергия используется для продолжения горения и не влияет на изменение температуры окружающей среды.
Реакции с изменением состояния агрегации: влияние изменения фазы на тепловой эффект
При изменении фазы вещества происходят существенные изменения во внутренней энергии системы. Как известно, для перехода вещества из одной фазы в другую необходимо или поглощение тепла, или его выделение. В этом случае тепловой эффект реакции определяется разницей между энергией начальной и конечной фаз.
Примером реакции с изменением состояния агрегации и влиянием фаз на тепловой эффект является конденсация водяного пара. При конденсации водяного пара происходит его переход из газообразного состояния в жидкое. В процессе конденсации происходит выделение тепла, которое связано с освобождением внутренней энергии молекул водяного пара при образовании молекул воды в жидкой фазе. Таким образом, конденсация водяного пара является экзотермической реакцией с отрицательным тепловым эффектом.
Другим примером является плавление льда. В процессе плавления льда происходит его переход из твердого состояния в жидкое. Этот процесс сопровождается поглощением тепла, что связано с поглощением энергии молекулами льда при разрушении кристаллической решетки и образовании молекул воды в жидкой фазе. Плавление льда является эндотермической реакцией с положительным тепловым эффектом.
Таким образом, изменение состояния агрегации вещества влияет на тепловой эффект реакции, определяя его знак (положительный или отрицательный). Этот аспект является важным для понимания тепловых эффектов химических реакций и их классификации.
Реакции с изменением окислительно-восстановительного потенциала: взаимодействие окислителя и восстановителя с энергетическим эффектом
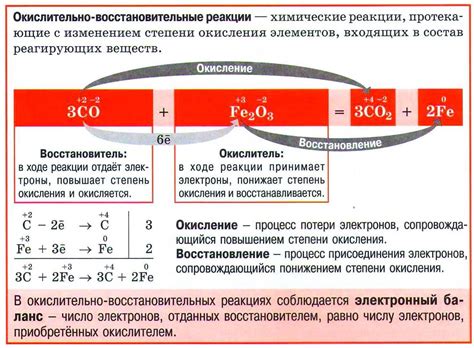
Окислитель - это вещество, которое получает электроны от вещества, окисление которого происходит. Восстановитель - это вещество, которое отдает электроны веществу, восстановление которого происходит.
В результате окислительно-восстановительной реакции происходит изменение окислительно-восстановительного потенциала (ОВП) системы. ОВП определяется способностью вещества быть окислителем или восстановителем. При окислении ОВП повышается, а при восстановлении ОВП понижается.
Взаимодействие окислителя и восстановителя сопровождается энергетическим эффектом. Если окислитель более сильный, то реакция будет экзотермической и сопровождаться выделением тепла. Если восстановитель более сильный, то реакция будет эндотермической и сопровождаться поглощением тепла.
| Примеры реакций с изменением ОВП: | Энергетический эффект: |
|---|---|
| Восстановление меди оксидом углерода: | Выделение тепла |
| Окисление алюминия хлором: | Выделение тепла |
| Восстановление хлора водородом: | Поглощение тепла |
| Окисление сероводорода кислородом: | Выделение тепла |




