Изотопы водорода – это атомы водорода, которые отличаются числом нейтронов в ядре и, следовательно, массой атома. Существуют три изотопа водорода: протий, дейтерий и тритий. Каждый из этих изотопов имеет свои свойства, которые определяют их химическое и физическое поведение.
Во-первых, протий является самым легким и наиболее распространенным изотопом водорода. Он состоит из одного протона без нейтронов в ядре. Протий обладает электронным зарядом, и его ядру свойственны обычные химические свойства водорода. Протий встречается в природе в огромных количествах и является основной составной частью воды и органических соединений.
Тем не менее, дейтерий и тритий имеют несколько отличные свойства. Дейтерий состоит из одного протона и одного нейтрона в ядре. Это придает дейтерию большую массу по сравнению с протием, и он может образовывать более сильные химические связи. Благодаря этим свойствам дейтерий используется в ядерной энергетике, радиоуглеродном анализе и масс-спектрометрии.
Тритий является самым тяжелым изотопом водорода. Он состоит из одного протона и двух нейтронов в ядре. Благодаря своей большей массе, тритий обладает радиоактивностью и может быть использован в ядерных реакторах. Тритий также используется в термоядерных реакциях и в процессе создания водородной бомбы. Однако он является очень редким и его источники сильно ограничены.
Различия свойств изотопов водорода
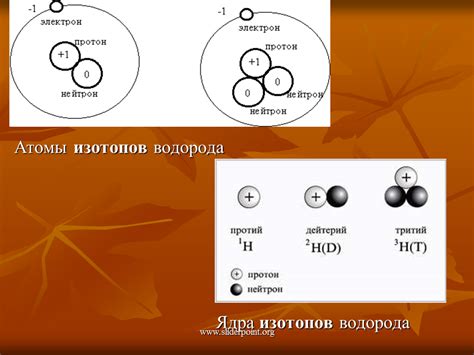
Дейтерий имеет один нейтрон в ядре, что делает его массу в два раза больше, чем у протия. Из-за этого у дейтерия более высокая плотность и более низкая температура кипения по сравнению с протием. Дейтерий также широко используется в ядерной энергетике и в качестве отслеживающего вещества в химических исследованиях.
Тритий - самый тяжелый изотоп водорода - имеет два нейтрона в ядре. Он является радиоактивным и обладает наиболее высокой плотностью и температурой кипения среди всех изотопов водорода. Тритий также используется в ядерной физике и ядерных реакторах в качестве топлива.
Различия свойств изотопов водорода в основном связаны с различиями в их массе. Большая масса дейтерия и трития влияет на их физические и химические свойства, такие как плотность, температура кипения и реакционная способность. Изучение этих различий помогает ученым лучше понять свойства водорода и его влияние на различные процессы в природе и технологиях.
Масса изотопов водорода
Водород образует три изотопа: протий, дейтерий и тритий. Они отличаются друг от друга количеством нейтронов в ядре и, следовательно, массой.
| Изотоп | Количество протонов | Количество нейтронов | Массовое число |
|---|---|---|---|
| Протий | 1 | 0 | 1 |
| Дейтерий | 1 | 1 | 2 |
| Тритий | 1 | 2 | 3 |
Массовое число изотопа водорода (H) определяется суммой количества протонов и нейтронов в ядре. Протий не имеет нейтронов, поэтому его массовое число равно 1. Дейтерий имеет один нейтрон и его массовое число равно 2. Тритий имеет два нейтрона и его массовое число равно 3.
Различия в массе изотопов влияют на их физические и химические свойства. Например, дейтерий и тритий являются непримесными изотопами водорода и используются в ядерных реакциях и технологиях. Они также влияют на физические свойства воды, такие как плотность, температура кипения и точка замерзания.
Ядерная структура изотопов водорода
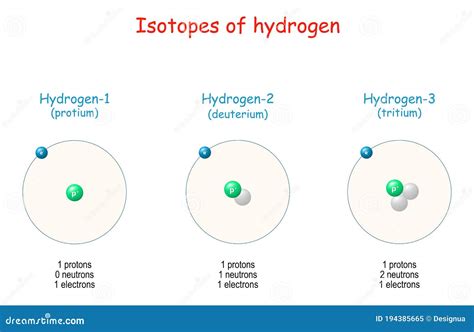
Ядро атома протия состоит из одного протона без нейтронов. Протий является самым распространенным изотопом водорода и составляет около 99,9% всех атомов этого элемента.
Дейтерий - это изотоп водорода, в ядре которого помимо протона присутствует один нейтрон. Именно наличие нейтрона делает дейтерий более тяжелым и устойчивым, чем протий. Благодаря этому, дейтерий используется в ядерной физике и ядерных реакторах.
Триитий - самый тяжелый изотоп водорода, в ядре которого находится два нейтрона и один протон. Триитий является радиоактивным и атомный номер его ядра равен 1.
Особенности ядерной структуры изотопов водорода обусловлены количеством нейтронов в ядре. Именно нейтроны влияют на массу и стабильность изотопа. Более тяжелые изотопы водорода, такие как дейтерий и триитий, имеют большую массу и более устойчивые ядра, что делает их полезными в различных научных и технических областях.
Реактивность изотопов водорода
Наиболее известными изотопами водорода являются протий, дейтерий и тритий. Протий является самым распространенным изотопом водорода и обладает наибольшей стабильностью. Дейтерий содержит один нейтрон в своем ядре и обладает большей массой и размером по сравнению с протием. Тритий содержит два нейтрона в своем ядре и является самым реактивным изотопом водорода.
Реактивность изотопов водорода связана с разностью в их атомных свойствах. Протий обладает наименьшей массой среди изотопов водорода и образует наиболее слабые связи с другими элементами. Дейтерий имеет большую массу и образует более сильные связи, что делает его более стабильным и менее реактивным. Тритий, в свою очередь, обладает наибольшей массой и является наиболее реактивным изотопом водорода.
Различная реактивность изотопов водорода имеет значительные последствия в химических реакциях и физических свойствах веществ. Например, тритий используется в ядерных реакциях и в качестве источника энергии в термоядерных реакторах. Дейтерий применяется в изотопной маркировке и исследованиях в области физики и биологии. Протий является основным компонентом большинства обычных веществ и служит важной составной частью молекул жизненно важных соединений, таких как вода.
Изотопный эффект
Дейтерий – изотоп водорода, состоящий из одного протона и одного нейтрона. Его масса примерно в два раза больше массы обычного водорода. Ключевая особенность дейтерия – наличие нейтрона, который придает ему стабильность и увеличивает время его перехода в другие состояния.
Тритий – еще более тяжелый изотоп водорода, состоящий из одного протона и двух нейтронов. Он имеет массу примерно в три раза больше массы обычного водорода и в полтора раза больше массы дейтерия. Из-за своей нестабильности тритий используется главным образом в ядерных реакциях.
Изотопный эффект становится заметным при физических и химических процессах, где происходит взаимодействие изотопов водорода с другими веществами. Он проявляется в изменении скорости реакций, в физико-химических свойствах веществ, а также может влиять на образование и структуру различных соединений.
Изотопный эффект имеет большое значение в различных областях науки и техники, включая ядерную физику, астрофизику, биохимию, катализ и геохимию. Изучение эффекта изотопов водорода позволяет лучше понять процессы, происходящие в природе и в живых системах, а также может применяться для разработки новых технологий и материалов.
Применение изотопов водорода
Изотопы водорода имеют широкое применение в различных областях науки и технологии. Вот некоторые из них:
- Изотоп водорода H-2 часто используется в ядерных реакторах в качестве теплоносителя. Благодаря своим уникальным свойствам, он обеспечивает высокую эффективность нейтронного захвата и хорошую радиационную стабильность.
- Изотоп водорода H-3 или тритий является радиоактивным и широко используется в исследовательских целях. Он используется для маркировки и отслеживания молекул в химических реакциях и биологических системах. Тритий также используется в ядерных реакциях для получения энергии и применяется в некоторых источниках ионации.
- Дейтерий (D) - изотоп водорода, состоящий из одного протона и одного нейтрона. Он широко используется в ядерной магнитной и резонансной томографии (ЯМРТ) для создания образов тканей. Дейтерий также используется в качестве маркера в фармакологических исследованиях и в анализе биологических процессов.
Применение изотопов водорода в научных и технических областях позволяет проводить различные исследования, улучшать процессы и разрабатывать новые технологии. Каждый из изотопов обладает своими уникальными свойствами, которые позволяют использовать их в различных приложениях.
Использование изотопов водорода в научных исследованиях

Изотопы водорода играют важную роль в научных исследованиях различных областей, начиная от астрофизики и заканчивая биохимией. Их уникальные свойства и возможности позволяют ученым расширить наши знания о мире и создать новые технологии.
Один из наиболее известных изотопов водорода – дейтерий. Он применяется, например, в ядерных реакторах и является критическим компонентом ядерных боеголовок. Дейтерий также используется в ядерной медицине для создания изотопных трассеров и контрастных веществ при проведении магнитно-резонансной томографии.
Тритий – еще один изотоп водорода, который имеет свои уникальные характеристики. Он используется в качестве источника энергии в термоядерных реакциях и в ядерных реакторах. Кроме того, тритий применяется в биологии и медицине для исследования процессов метаболизма и диагностики заболеваний.
Тяжелая вода, содержащая дейтерий, также находит применение в научных исследованиях, особенно в области химии и радиохимии. Она используется в качестве растворителя и реагента при проведении различных экспериментов. Тяжелая вода играет важную роль в ядерной физике, где используется для замедления и модерации нейтронов.
Изотопы водорода также применяются в биохимии и биологии. Они позволяют ученым изучать процессы обмена водорода между организмами и окружающей средой. Благодаря этому исследователи могут проследить пути происхождения различных молекул и изучить их влияние на живые организмы.
| Изотоп водорода | Применение |
|---|---|
| Дейтерий | Ядерные реакции, ядерная медицина |
| Тритий | Термоядерные реакции, ядерные реакторы, биология, медицина |
| Тяжелая вода | Химия, радиохимия, ядерная физика |




