Изомерия - это явление, при котором молекулы химических соединений имеют одинаковую молекулярную формулу, но различаются в устройстве своих атомов и/или пространственном расположении. Такие соединения называются изомерами.
Изомерия может проявляться в разных формах, включая структурную изомерию, геометрическую изомерию и оптическую изомерию. Структурная изомерия возникает, когда атомы соединения связываются по-разному, что приводит к образованию различных структурных формул.
Геометрическая изомерия относится к случаям, когда атомы соединения имеют одинаковое пространственное расположение, но отличаются ориентацией вокруг двойной связи или другого функционального группирования. Оптическая изомерия возникает, когда молекулы обладают хиральностью, то есть несуперимпозируемой зеркальной симметрией.
Примерами изомерии могут быть:
- Геометрическая изомерия: изомеры А и В, где атомы имеют одинаковое расположение, но различаются ориентацией двойной связи. Примером может быть цис- и транс-изомеры в органических соединениях.
- Оптическая изомерия: главное отличие между изомерами состоит в различной способности поворачивать плоскость поляризации света. Примерами могут быть лево- и правовращающие изомеры в органических соединениях.
- Структурная изомерия: изомеры А и В, где атомы имеют различное расположение и связи. Примерами могут быть циклические изомеры в органической химии, такие как циклогексан и его структурные изомеры.
Изомерия является важным концептом химии, так как она может существенно влиять на физические и химические свойства соединений, включая их стабильность и реакционную способность. Понимание и классификация изомерии играет важную роль в разных областях науки, включая органическую и неорганическую химию, фармацевтику и материаловедение.
Изомерия: понятие, виды и примеры
Существует несколько видов изомерии:
1. Структурная изомерия – это различие в строении молекул изомеров. Внутри этой группы выделяются подвиды: цепная, местная, функциональная, метамерия и таутомерия.
2. Пространственная (конформационная) изомерия – это различие в пространственном расположении атомов в молекуле. Примерами такой изомерии могут служить конформеры и энантиомеры.
3. Оптическая изомерия – это различие в световом поведении изомеров, связанное с их способностью поворачивать плоскость поляризованного света. К оптической изомерии относятся две формы: декстро- и лево-изомеры.
Примеры изомерии включают в себя следующие соединения:
- Пара соединений ацетальдегид и этиловый эфир являются функциональными изомерами, так как они имеют различные функциональные группы: альдегидную и эфирную группу соответственно.
- Изомерия конформации наблюдается, например, у циклогексана, который может принимать две различные пространственные конформации – стул и бутан.
- Оптическую изомерию проявляют, например, сахароза и фруктоза, которые являются оптическими изомерами друг друга.
Что такое изомерия?
Изомерия является результатом того, что атомы в молекулах могут составлять разные структуры, что влияет на их физические и химические свойства.
Существует несколько типов изомерии, включая структурную, геометрическую и оптическую изомерию. Структурная изомерия возникает, когда атомы в молекуле расположены по-разному. Геометрическая изомерия проявляется при наличии двух различных групп вокруг двойной связи. Оптическая изомерия связана с возможностью взаимодействия со светом.
Изомерия имеет большое значение в химии и биологии, так как изомеры могут иметь различные физические, химические и биологические свойства. Это делает изомерию полезной для научных и практических исследований, а также в промышленных процессах.
Структурная изомерия: определение
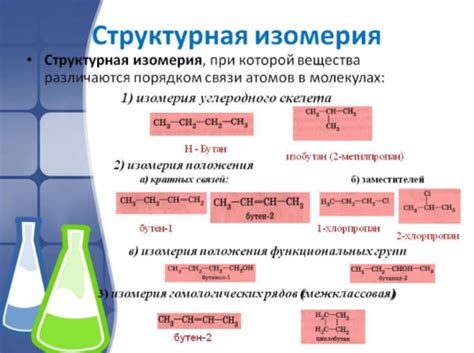
Структурная изомерия может быть объяснена различными способами:
- Изомерия цепи - различие в порядке, продолжительности или расположении атомов в цепи углеродных атомов.
- Изомерия функциональных групп - различие в типе или расположении функциональных групп в молекуле.
- Изомерия позиции - различие в расположении функциональных групп или повороте молекулы на оси, что приводит к отличиям в структуре и свойствах.
Структурная изомерия играет важную роль в химии, поскольку малейшие изменения в структуре молекулы могут привести к значительным различиям в ее физических и химических свойствах. Поэтому, понимание структурной изомерии имеет большое значение для молекулярного проектирования и синтеза новых соединений.
Конституционная изомерия: примеры
Примерами конституционной изомерии могут служить следующие соединения:
- Этанол и эфир метоксиэтанол. Оба соединения имеют формулу C2H6O, но у них различная структура связей атомов. В случае этанола, кислородная атом атома водорода соединен с углеродом, в то время как в случае эфира метоксиэтанола - с другим атом водорода.
- Пропан и изо-бутан. Оба соединения имеют формулу C3H8, но их молекулы различаются структурой связей атомов. У пропана все три атома углерода находятся на одной прямой, а у изо-бутана - два атома углерода находятся на одной прямой, а третий находится на боковой ветви.
- Метанол и формальдегид. Оба соединения имеют формулу CH2O, но молекулы этих соединений отличаются своей структурой связей. Молекула метанола состоит из атома углерода, двух атомов водорода и атома кислорода, в то время как молекула формальдегида состоит из атома углерода, двух атомов водорода и двух атомов кислорода.
Вышеперечисленные примеры демонстрируют различную структуру связей атомов в молекулах, несмотря на их одинаковый химический состав. Это позволяет им обладать разными физическими свойствами и проявлять различное химическое поведение.
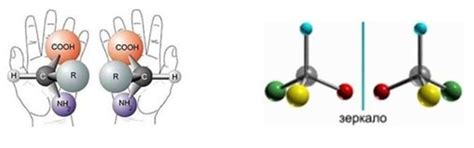
Стереоизомерия: виды и примеры

Существует два основных вида стереоизомерии: зеркальная (энантиомерия) и конституционная (диастереомерия).
Энантиомеры - это пары изомеров, которые являются зеркальными отражениями друг друга и несуперпозиционируемы. Они отличаются только своим оптическим вращением и взаимодействием с поляризованным светом. Примером таких стереоизомеров являются левая и правая рука.
Диастереомеры - это стереоизомеры, которые не являются зеркальными отражениями друг друга. Они обладают разными физическими и химическими свойствами. Примером диастереомеров являются цис- и транс-изомеры двойных связей.
Таблица ниже демонстрирует различия между зеркальными и конституционными стереоизомерами:
| Тип стереоизомерии | Характеристики | Пример |
|---|---|---|
| Энантиомерия | Зеркальные отражения, оптическое вращение | Левоциталин и декстроциталин |
| Диастереомерия | Не являются зеркальными отражениями | Цис- и транс-изомеры |
Стереоизомерия важна в химии и биохимии, так как даже незначительные изменения в пространственной конфигурации молекул могут оказывать существенное влияние на их физические и химические свойства, а также на их взаимодействие с другими молекулами.
Пространственная изомерия: объяснение и примеры
Одним из наиболее распространенных примеров пространственной изомерии является цис-транс изомерия у двойных связей. В этом случае, два атома, соединенные двойной связью, могут находиться либо по одну сторону (цис-изомер), либо по разные стороны (транс-изомер) от оси связи. Это приводит к различным свойствам и реакционной активности таких изомеров.
Другим примером пространственной изомерии является геометрическая изомерия у комплексных соединений. В таких молекулах может происходить изменение в расположении лигандов вокруг центрального металла, что влияет на их реакционную активность и способность образовывать соединения с разными свойствами.
Пространственная изомерия имеет большое значение в таких областях, как фармакология и катализ. Различные изомеры молекул могут обладать разными физико-химическими свойствами и, следовательно, разным влиянием на биологические системы или химические реакции.
Таутомерия: обзор и примеры
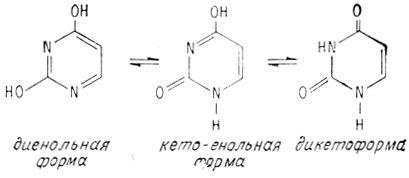
В основе таутомерии лежит перекочевывание протона или группы атомов между различными атомами в молекуле. В результате изменения состава или структуры молекулы возникают разные изомеры.
Примером таутомерии является фенол и его таутомер оцинкловении – кинолин. Фенол имеет формулу C6H6O, а кинолин – C9H7N. В молекуле фенола атом водорода может перекочевать между группой -ОН и атомом углерода, образуя два таутомера. Эти соединения обладают разными свойствами и могут участвовать в разных реакциях.
Также известна таутомерия пиримидина и пиридона. Пиримидин – это азотсодержащий гетероциклический соединение с формулой C4H4N2, а пиридон – C5H5NO. В молекуле пиримидина связь между атомами C2 и N1 может перекочевать, образуя два таутомера. Эти соединения также обладают разными свойствами и могут участвовать в разных реакциях.
Таутомерия имеет большое значение в области органической химии, так как может влиять на реакционную способность и свойства соединений. Изучение этого явления позволяет лучше понять механизмы химических реакций и применять полученные знания в синтезе органических соединений.




