Изомерия - это явление, при котором химические соединения имеют одинаковое молекулярное состав, но различную структуру. Другими словами, это свойство некоторых веществ образовывать молекулы с одним и тем же количеством атомов, но с разным расположением этих атомов в пространстве.
Изомерия может проявляться на разных уровнях: структурном, функциональном и стереоизомерическом. Структурная изомерия связана с различной последовательностью связей атомов в молекуле, функциональная изомерия - с наличием различных функциональных групп, а стереоизомерия - с разным пространственным расположением атомов относительно друг друга.
Примером структурной изомерии может служить изомеры гексана: нормальный гексан (n-гексан) и изо-гексан имеют общую формулу C6H14, но различаются расположением углеродных атомов в цепи. Функциональная изомерия иллюстрируется, например, н-пропанолом и изопропанолом, которые оба имеют формулу C3H8O, но различаются наличием гидроксильной группы (OH) в разных местах молекулы.
Стереоизомерия можно наблюдать в случае цис- и транс-изомеров двуххлорбутена. Оба изомера имеют формулу C4H8Cl2, но отличаются пространственным расположением двух хлор-атомов: в цис-изомере они находятся по одну сторону двойной связи, а в транс-изомере - по разные стороны связи.
Таким образом, изомерия - удивительное явление, которое помогает разнообразить химический мир и открыть новые свойства веществ. Понимание изомерии играет важную роль в органической химии и позволяет лучше понять структуру и свойства молекул.
Изомерия: понятие и классификация
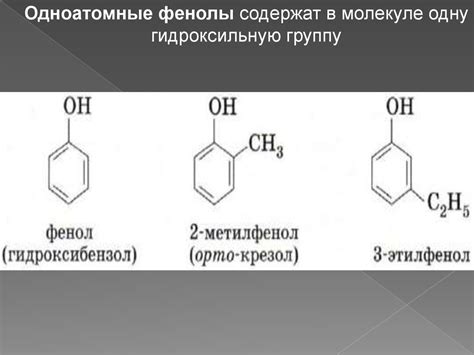
Изомеры могут отличаться расположением атомов в пространстве или последовательностью атомов в молекуле. В зависимости от вида отличий, изомерия подразделяется на:
1. Структурную (конституционную) изомерию, в которой атомы могут быть упорядочены по-разному внутри молекулы. Например, изомерами бутана являются нормальный бутан (CH3-CH2-CH2-CH3) и изо-бутан (CH3-CH(CH3)2).
2. Пространственную изомерию, где атомы могут иметь различное пространственное расположение. Например, существуют два изомера для хлорфторированного этилена - 1,1-дихлорэтилен, где атомы хлора расположены на одном угле двойной связи, и 1,2-дихлорэтилен, где атомы хлора расположены на разных углах двойной связи.
3. Функциональную (групповую) изомерию, в которой изомеры имеют различные функциональные группы. Например, у этилового спирта (CH3CH2OH) и диметилового эфира (CH3OCH3) разные функциональные группы - гидроксильная группа и оксигруппа соответственно.
Изомерия является важной характеристикой органических соединений. Различные изомеры могут иметь различные свойства и реакционную способность, что делает их использование в различных областях науки и промышленности.
Стереоизомерия: симметрия и конфигурация
Строение хиральных молекул отличается от ахиральных тем, что хиральная молекула и ее зеркальное отображение не могут совпасть друг с другом при любом повороте, сдвиге или переносе. Это свойство называется нематической симметрией. Если же структуры молекул и их зеркального отображения могут совпасть, то такая симметрия называется планарной.
Кроме симметрии, стереоизомерия также связана с конфигурацией молекулы. Конфигурация определяет пространственное расположение заместителей хирального центра. Существует два основных типа конфигурации – R и S. Группы заместителей, связанные с хиральным атомом, располагаются в порядке против часовой стрелки вокруг атома – это S-конфигурация. А если группы заместителей располагаются по часовой стрелки, то это R-конфигурация.
Стереоизомерия имеет важное значение в химии и биохимии. Она может влиять на свойства молекул, их активность, стабильность и взаимодействие с другими веществами. Например, одна стереоизомерия медицинского препарата может иметь желаемое лечебное действие, а ее зеркальное отображение – нет. Поэтому изучение стереоизомерии является важным аспектом фармацевтической и органической химии.
Структурная изомерия: цепная, функциональная и групповая
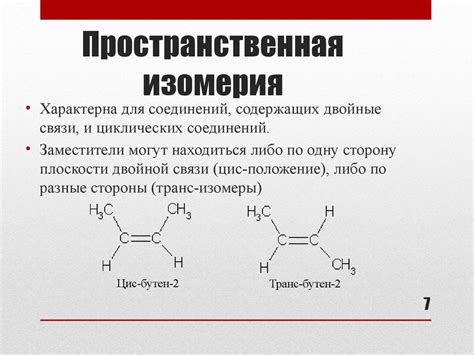
Структурной изомерией можно назвать замещение атомов в углеводородной цепи. При цепной изомерии количество атомов одного типа в молекуле остается неизменным, но их расположение может изменяться. Например, молекула бутана (C4H10) имеет два цепных изомера - изобутан и нормал-бутан. В изобутане третий углерод атом связан с одним другим углеродом и тремя водородными атомами, а в нормал-бутане - с двумя другими углеродами и двумя водородными атомами.
Функциональная изомерия возникает, когда у молекул соединений одинаковая молекулярная формула, но различные функциональные группы. Например, альдегид бутиральдегид (C4H8O) и кетон метилэтилкетон (C4H8O) - это функциональные изомеры.
Также существует групповая изомерия, при которой одна и та же функциональная группа находится в разных молекулярных окружениях. Например, мы можем выделить два изомера с ненасыщенными карбоновыми кислотами- представительницами группы, это пропеновую кислоту (C3H4O2) и глютаровую кислоту (C4H6O2).
Таутомерия: обратимые превращения изомеров
Процесс таутомерии происходит благодаря смещению двойной и одинарной связей внутри молекулы. В результате изменения внутреннего строения, изомеры становятся химически различимыми. Однако, таутомерия обратимым процессом, что означает, что молекулы могут изменять свою структуру в ответ на внешние условия.
Примером таутомерии является фенол и онион оксимеле. У обоих веществ есть общая формула C6H5OH, но они отличаются внутренней структурой. Фенол представляет собой ароматическое кольцо с гидроксильной группой (-OH), а онион оксимель имеет кетогидразоновую группу (=N-OH).
Под действием воды, фенол может претерпеть таутомерное превращение в онион оксимель. В результате взаимодействия соединения с водой, гидроксильная группа из фенола переходит на азогруппу в онион оксимеле. Обратно, онион оксимель может вернуться в фенол путем удаления азогруппы и образования гидроксильной группы.
Таутомерия важна в органической химии, так как она может оказывать влияние на реакционную способность и стабильность изомеров. Понимание таутомерии позволяет ученым предсказывать и объяснять поведение молекул и разрабатывать новые препараты и материалы.
Изомерия в органической химии: примеры и объяснение
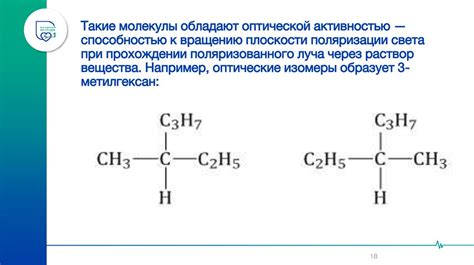
Существует несколько видов изомерии, которые можно встретить в органической химии:
| Вид изомерии | Описание |
|---|---|
| Структурная изомерия | Изомеры, которые отличаются отличаются взаимным расположением атомов в молекуле. Например, метан и этан являются структурными изомерами, так как у них различается количество и расположение атомов углерода и водорода. |
| Функциональная изомерия | Изомеры, которые имеют различные функциональные группы в молекуле. Например, эфир и алканол являются функциональными изомерами, так как у них различные функциональные группы (оксигруппа и гидроксигруппа). |
| Цепная изомерия | Изомеры, которые имеют различную последовательность атомов в углеродной цепи. Например, пентан и изопентан являются цепными изомерами, так как у них различная последовательность атомов углерода. |
| Позиционная изомерия | Изомеры, которые отличаются расположением функциональных групп или двойных связей в углеродной цепи. Например, 2-хлорбутан и 1-хлорбутан являются позиционными изомерами, так как у них различное расположение хлора в углеродной цепи. |
| Зеркальная изомерия | Изомеры, которые являются зеркальным отражением друг друга. Например, L-альдоза и D-альдоза являются зеркальными изомерами, так как у них зеркальное отражение атомов в молекуле. |
Изомерия является ключевым понятием в органической химии, так как позволяет объяснить разнообразие органических соединений и их свойств. Понимание изомерии позволяет химикам лучше понять и предсказать химические реакции и свойства органических соединений.




