Тепловой эффект реакции - это количество тепла, которое выделяется или поглощается во время химической реакции. Он является важным параметром при изучении химических процессов, поскольку может влиять на эффективность и продуктивность реакции.
Однако, несмотря на его значимость, тепловой эффект реакции не зависит от таких факторов, как концентрация реактивов, скорость реакции или фазовое состояние веществ. Это может показаться неожиданным, поскольку многие химические процессы, казалось бы, должны сопровождаться выделением или поглощением тепла в зависимости от условий.
Почему же это происходит? Все дело в том, что тепловой эффект реакции определяется исключительно разницей в энергии между начальными и конечными состояниями системы. Более точно, это изменение в энергии связей между атомами веществ, которые участвуют в реакции.
При реакции происходит изменение распределения электронов, что влечет изменение энергии связей. Как только реактивы превращаются в продукты, энергетическое состояние системы меняется, и разница в энергии связей приводит к выделению или поглощению тепла.
Тепловой эффект реакции: от чего он не зависит
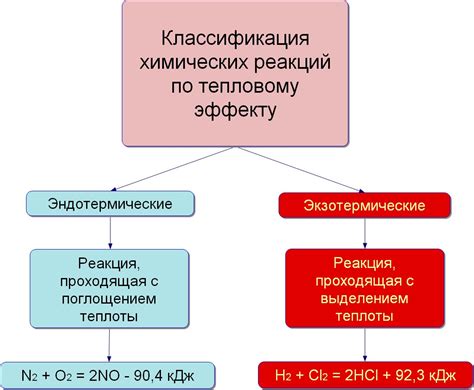
Однако, тепловой эффект реакции не зависит от следующих факторов:
Количества веществ, участвующих в реакции: Количество веществ, присутствующих в реакционной смеси, не влияет на тепловой эффект реакции. Тепло, которое выделяется или поглощается, зависит только от изменения энергии связей между атомами веществ.
Концентрации реагентов: Концентрация реагентов также не оказывает прямого влияния на тепловой эффект реакции. Изменение концентрации реагентов может влиять на скорость реакции, но не на количество выделяющегося тепла.
Энтальпии образования веществ: Энтальпия образования веществ, т.е. тепловое энергетическое состояние веществ при их образовании из элементарных веществ, также не оказывает непосредственного влияния на тепловой эффект реакции.
Тепловой эффект реакции определяется разностью энтальпий между продуктами и реагентами, а не их абсолютными значениями.
Влияние катализаторов
Катализаторы могут как увеличивать, так и уменьшать тепловой эффект реакции. Например, в присутствии катализатора может происходить реакция с выделением тепла, которая без катализатора проходит с поглощением. Это объясняется тем, что катализатор ускоряет образование промежуточных соединений и снижает энергию активации, что приводит к более высокой скорости образования конечных продуктов.
Кроме того, катализаторы могут изменять характер реакции, что приводит к изменению теплового эффекта. Например, в присутствии катализатора может происходить обратная реакция, которая без катализатора идет только в одну сторону. В этом случае, тепловой эффект реакции будет обратным по сравнению с реакцией без катализатора.
Таким образом, влияние катализаторов на тепловой эффект реакции является сложным и зависит от конкретного реакционного механизма. Катализаторы можно использовать для управления тепловым эффектом исходной реакции и повышения ее эффективности.
| Примеры катализируемых реакций с изменением теплового эффекта |
|---|
| Реакция аммиака с кислородом: |
| 2NH3 + 3O2 → 2NO + 6H2O + тепло (без катализатора) |
| 2NH3 + 3O2 → 2NO + 6H2O + 450 кДж (с катализатором) |
| Реакция окисления водорода: |
| 2H2 + O2 → 2H2O + тепло (без катализатора) |
| 2H2 + O2 → 2H2O + 572 кДж (с катализатором) |




