Гидроксиды – это класс химических соединений, которые образуются при реакции щелочей с водой. Они широко изучаются восьмиклассниками в курсе химии. Гидроксиды являются основаниями, то есть веществами, которые обеспечивают отрицательное значение реакции среды. Они обладают своеобразными физическими и химическими свойствами, которые помогают определить их роль в различных процессах.
Свойства гидроксидов могут различаться в зависимости от их состава. Однако, есть общие характеристики, которые объединяют все гидроксиды. Во-первых, они обладают щелочными свойствами, что означает, что они могут реагировать с кислотами, образуя соль и воду. Во-вторых, гидроксиды обычно являются кристаллическими веществами с определенными структурами. И наконец, они обладают хорошей растворимостью в воде, что делает их доступными для использования в различных химических процессах.
Примеры гидроксидов включают такие вещества, как гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и гидроксид алюминия (Al(OH)3). Гидроксид натрия, или щелочь, широко применяется в производстве мыла, чистящих средств и бытовых растворов. Гидроксид кальция, или известковая вода, используется в строительстве и в сельском хозяйстве. Гидроксид алюминия, или алюминий гидроксид, используется в производстве алюминия и препаратах от желудочно-кишечных заболеваний.
Гидроксиды: определение, принцип действия, примеры

Гидроксиды обладают основными свойствами, такими как щелочность и способность взаимодействовать с кислотами. Когда гидроксиды взаимодействуют с кислотами, они образуют соль и воду. Принцип действия гидроксидов основан на этой реакции:
Гидроксид + Кислота → Соль + Вода
Примером гидроксида является гидроксид натрия (NaOH). При реакции с кислотой, например серной (H2SO4), образуется соль - сульфат натрия (Na2SO4) и вода (H2O).
Другим примером гидроксида является гидроксид аммония (NH4OH). При взаимодействии с кислотой, такой как хлороводородная (HCl), образуется соль - хлорид аммония (NH4Cl) и вода.
Гидроксиды широко используются в различных отраслях промышленности и научных исследованиях. Они могут применяться как щелочные растворители, регуляторы pH, катализаторы и многое другое.
Строение и свойства гидроксидов
Гидроксиды представляют собой соединения, состоящие из иона гидроксила (OH-) и металла. Строение гидроксидов может быть описано как кристаллическая решетка, в которой ионы гидроксила окружены ионами металла.
Свойства гидроксидов зависят от типа металла, который присутствует в соединении. Однако, среди общих свойств гидроксидов можно выделить следующие:
- Гидроксиды обладают щелочными свойствами, то есть они растворяются в воде, образуя растворы с щелочной реакцией.
- Гидроксиды металлов группы 1 (щелочные металлы) обычно растворяются хорошо в воде и образуют щелочные растворы.
- Гидроксиды металлов группы 2 (щелочноземельные металлы) растворяются хуже и образуют меньше гидроксидных ионов в растворе.
- Гидроксиды некоторых переходных металлов обладают амфотерными свойствами, то есть могут реагировать как с кислотами, так и с щелочами.
- Гидроксиды обычно образуют твердые соединения с высокой температурой плавления.
Примерами гидроксидов являются гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и гидроксид алюминия (Al(OH)3).
Классификация гидроксидов
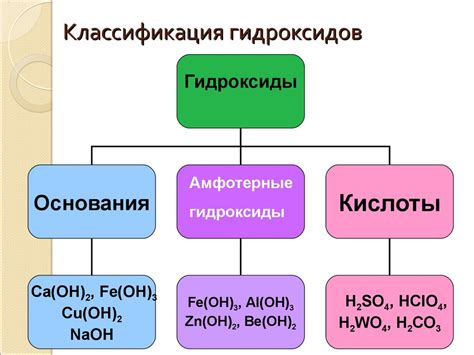
1. Одноосновные гидроксиды
Одноосновные гидроксиды состоят из одной молекулы металла и одного гидроксильного иона. Примером такого гидроксида является гидроксид натрия (NaOH). Он широко используется в различных отраслях промышленности и быта, например, в производстве стекла, мыла и очистки сточных вод.
2. Двухосновные гидроксиды
Двухосновные гидроксиды состоят из двух молекул металла и одного гидроксильного иона. Примером такого гидроксида является гидроксид железа (II) [Fe(OH)2]. Он обладает амфотерными свойствами и используется в производстве красок, пигментов и лекарственных препаратов.
3. Многоосновные гидроксиды
Многоосновные гидроксиды содержат несколько молекул металла и одну или несколько гидроксильных групп. Примером такого гидроксида является гидроксид алюминия (Al(OH)3). Он применяется в производстве керамики, алюминиевых сплавов и лекарственных препаратов.
Классификация гидроксидов позволяет упростить изучение их свойств и применение в различных сферах науки и промышленности.
Применение гидроксидов в промышленности
Одно из главных применений гидроксидов - это использование в качестве присадок для производства различных материалов. Например, гидроксид натрия (NaOH), или щелочь, используется в производстве мыла, бумаги, стекла и многих других материалов. Гидроксид кальция (Ca(OH)2) используется в строительстве и производстве цемента.
Гидроксиды также применяются в процессе обработки воды. Например, гидроксид алюминия (Al(OH)3) используется в процессе флокуляции, чтобы удалить взвешенные вещества из воды и сделать ее пригодной для питья. Гидроксид калия (KOH) используется в процессе обеззараживания воды.
Другое важное применение гидроксидов - это их использование в электрохимических процессах. Например, гидроксид натрия используется в процессе электролиза для производства щелочи и хлора. Гидроксид железа (Fe(OH)3) используется в процессе гальванизации, чтобы нанести защитное покрытие на поверхности металла.
Помимо этого, гидроксиды находят применение в производстве удобрений, пестицидов, косметических препаратов и многих других продуктов. Они также используются в лабораториях и фармацевтической промышленности.
Гидроксиды являются важными химическими соединениями, которые успешно применяются в различных сферах промышленности. Их свойства и уникальные химические возможности делают их востребованными во многих процессах и производствах.
Важные представители гидроксидов
Гидроксиды представляют собой класс химических соединений, которые образуются в результате реакции оксида металла с водой. Важные представители данного класса включают:
| Название | Формула | Свойства | Применение |
|---|---|---|---|
| Гидроксид натрия | NaOH | Безцветные кристаллы, растворим в воде, щелочной реагент | Используется в производстве стекла, мыла и мочевины, а также в пищевой промышленности |
| Гидроксид калия | KOH | Белые кристаллы, растворим в воде, щелочной реагент | Применяется в производстве мыла, удобрений и в пищевой промышленности |
| Гидроксид алюминия | Al(OH)3 | Белый аморфный порошок, плохо растворим в воде | Используется в производстве красителей, алюминиевых изделий и в косметической промышленности |
Эти гидроксиды имеют широкое применение в различных отраслях промышленности и исследованиях, и являются важными соединениями в химии.
Роль гидроксидов в химических реакциях
Гидроксиды играют важную роль во многих химических реакциях. Они могут выступать как реагенты, продукты или катализаторы в различных процессах.
Во-первых, гидроксиды могут реагировать с кислотами, образуя соль и воду. Это называется нейтрализацией. Например, реакция между гидроксидом натрия (NaOH) и соляной кислотой (HCl) приводит к образованию соли хлорида натрия (NaCl) и воды.
Во-вторых, гидроксиды могут реагировать с кислотными оксидами, образуя соли. Например, гидроксид натрия (NaOH) реагирует с угольной кислотой (H2CO3) и образует натрий карбонат (Na2CO3) и воду.
Гидроксиды также могут участвовать в реакциях образования осадка. Например, гидроксид алюминия (Al(OH)3) может образовывать осадок, если добавить к нему ион аммония (NH4+). Формируется осадок алюминия и аммония.
Кроме того, гидроксиды могут служить катализаторами в химических реакциях. Например, гидроксид натрия (NaOH) может ускорять гидролиз жира, образуя глицерин и соли жирных кислот.
Таким образом, гидроксиды имеют широкий спектр реакционной активности и играют важную роль в различных процессах в химии.
Практические примеры использования гидроксидов в повседневной жизни
Вот несколько примеров использования гидроксидов:
| Продукт | Применение |
|---|---|
| Гидроксид натрия (NaOH) | Используется для очистки и обезжиривания поверхностей в домашнем хозяйстве, а также в промышленных процессах. Он является основным компонентом дряней, моющих средств и моющих порошков. |
| Гидроксид калия (KOH) | Применяется в производстве щелочных батарей и аккумуляторов. Этот гидроксид также используется для изготовления мыла и косметических продуктов. |
| Гидроксид кальция (Ca(OH)2) | Известен как известь, он широко используется в строительстве и производстве строительных материалов. Также он применяется в сельском хозяйстве для улучшения почвы и в лечебных целях в медицине. |
| Гидроксид алюминия (Al(OH)3) | Используется в качестве антацида в лекарствах для лечения изжоги и избыточной кислотности. Также этот гидроксид применяется в производстве огнеупорных материалов и косметических продуктов. |
| Гидроксид магния (Mg(OH)2) | Известен как молочная известь, этот гидроксид используется как лекарственное средство в медицине для лечения изжоги и желудочных заболеваний. Также он применяется в производстве огнеупорных материалов и косметических продуктов. |
Это только некоторые примеры использования гидроксидов в повседневной жизни. Эти соединения играют значительную роль в различных отраслях, и их применение продолжает расширяться.




