Электролиты - это вещества, способные диссоциировать в водных растворах на положительно и отрицательно заряженные ионы. Такая диссоциация делает электролиты отличительными от других веществ, которые не обладают проводимостью электрического тока. Проводимость электролитов обусловлена наличием свободных заряженных частиц - ионов, которые перемещаются под действием электрического поля.
Проводимость электролитов может быть связана как с ионами, образующими электролит, так и с ионами исходного вещества. В процессе диссоциации электролита в водном растворе ионы выполняют роль носителей электрического тока. Это объясняет, почему электролиты являются отличными проводниками электрического тока и находят широкое применение в различных областях науки и техники.
Природа проводимости электролитов связана с особенностями взаимодействия ионов с молекулами воды. Водные растворы электролитов обладают положительным или отрицательным электрическим зарядом, что обусловлено присутствием ионов в растворе. Ионы в водном растворе размещаются таким образом, чтобы положительные заряды окружали отрицательные, и наоборот.
При проведении электрического тока через раствор происходит движение ионов, причем положительные ионы движутся к отрицательному электроду, а отрицательные - к положительному. Данное явление объясняется электростатическим притяжением противоположно заряженных частиц. Таким образом, проводимость электролитов обусловлена движением ионов под действием электрического поля и способностью ионов образовывать и поддерживать электростатический баланс в растворе.
Понятие электролитов

К основным типам электролитов относятся сильные и слабые электролиты. Сильные электролиты диссоциируют полностью и образуют большое количество ионов в растворе. Примерами сильных электролитов являются соляные кислоты, щелочи и соли. Слабые электролиты, напротив, диссоциируют лишь частично и образуют небольшое количество ионов. Примерами слабых электролитов являются уксусная кислота и аммиак.
Ионы, образованные при диссоциации электролита, обладают электрическими зарядами и отрицательными или положительными. Наличие ионов в растворе обуславливает проводниковую способность электролита. Именно эта способность позволяет электролитам превратиться в электролитные растворы, которые находят широкое применение в различных областях науки и техники, а также в жизни человека.
Типы электролитов
- Ионные электролиты: состоят из ионов, положительных и отрицательных, которые образуются при диссоциации соединения в растворе. Примеры ионных электролитов включают соли (например, хлорид натрия), кислоты и основания. Ионные электролиты обладают высокой проводимостью, так как ионы могут свободно двигаться в растворе.
- Ковалентные электролиты: состоят из неполярных молекул, которые могут образовывать электролитический раствор при растворении в воде или другом растворителе. Примеры ковалентных электролитов включают кислород, воду, ацетон и многие другие органические соединения. Ковалентные электролиты могут иметь низкую проводимость, так как для передачи тока необходимо, чтобы их молекулы подверглись диссоциации или ионизации.
- Полярные электролиты: обладают полярной связью, что создает разделение зарядов внутри молекулы. Это позволяет полярным электролитам создавать электролитические растворы с высокой проводимостью. Примеры полярных электролитов включают некоторые водные растворы кислот и оснований.
Различные типы электролитов обладают разной проводимостью и химическими свойствами. Изучение этих различий позволяет лучше понять природу и механизмы проводимости электролитов и их применение в различных областях науки и техники.
Строение электролитов
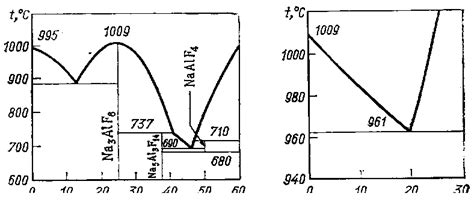
Электролиты представляют собой вещества, способные в растворенном состоянии образовывать электрически заряженные ионы. Строение электролитов определяет их способность к проводимости электрического тока.
В состав электролитов входят положительно или отрицательно заряженные ионы. Положительные ионы называют катионами, а отрицательные - анионами. В устойчивой разновидности с протеканием электрического тока количество положительных и отрицательных зарядов, т.е. ионов, равно друг другу.
Ионный заряд электролитов связан со свойствами его атомов или молекул. Как правило, ионный заряд электролитов может быть определен их валентностью, которая указывает на количество электронов, участвующих в образовании ионов.
В процессе проведения электрического тока в электролите положительно заряженные катионы движутся к отрицательно заряженной электроде, а отрицательно заряженные анионы - к положительно заряженной электроде. Благодаря этому электролиты проявляют свои проводимостные свойства.
Строение электролитов значительно влияет на их проводимость. Чем больше концентрация ионов в растворе, тем выше проводимость электролита. Также влияние оказывают размеры и масса ионов, а также их заряд. Кроме того, на проводимость электролитов влияют температура и давление.
Изучение строения электролитов является важным шагом в понимании их проводимости и свойств. Благодаря этому можно эффективно использовать электролиты в различных областях, включая электрохимию, энергетику и биологию.
Механизмы проводимости электролитов
Проводимость электролитов определяется механизмами, которые обеспечивают перемещение заряженных частиц внутри раствора. Существует несколько основных механизмов проводимости электролитов.
1. Диффузия. Диффузия – это механизм перемещения молекул или ионов из области с более высокой концентрацией в область с более низкой концентрацией. В случае электролитов, положительно и отрицательно заряженные ионы диффундируют независимо друг от друга под действием концентрационного градиента.
2. Электромиграция. Электромиграция – это механизм проводимости, при котором заряженные частицы перемещаются под действием электрического поля. В электролите положительно заряженные ионы движутся в сторону отрицательного электрода, а отрицательно заряженные ионы – в сторону положительного электрода.
3. Ассоциация и диссоциация. Электролиты могут существовать в растворе в виде недиссоциированных молекул или ионов. Механизм проводимости электролитов через ассоциацию и диссоциацию заключается в том, что недиссоциированные молекулы электролитов ассоциируются или диссоциируют под воздействием электрического поля, образуя заряженные ионы, которые затем перемещаются по раствору.
4. Протонная проводимость. В некоторых электролитах проводимость осуществляется за счет перемещения протонов. Протонная проводимость играет важную роль в электролитах, содержащих воду, таких как кислоты и щелочи. Перемещение протонов обеспечивает передачу заряда в растворе и участвует в множестве химических реакций.
Таким образом, проводимость электролитов обусловлена сочетанием различных механизмов, которые позволяют заряженным частицам перемещаться в растворе и создавать электрический ток.
Физические свойства электролитов

Растворимость: электролиты обладают высокой степенью растворимости в воде или других растворителях. Это связано с их способностью диссоциировать на ионы при контакте с растворителем.
Электропроводность: электролиты могут проводить электрический ток благодаря наличию свободных ионов в растворе. Ионы обладают положительным или отрицательным зарядом и перемещаются под воздействием электрического поля.
Электролитическая диссоциация: при растворении электролиты диссоциируют на ионы. Это процесс разделения молекулы электролита на положительно и отрицательно заряженные ионы. Электролитическая диссоциация обеспечивает наличие свободных ионов в растворе.
Электролитическая проводимость: способность электролита проводить электрический ток зависит от его концентрации и ионной подвижности. Чем выше концентрация ионов, тем выше проводимость электролита. Также важно, насколько легко ионы могут перемещаться в растворе.
Ионная подвижность: ионы электролита могут свободно перемещаться в растворе. Их подвижность зависит от размера, заряда и формы иона, а также от взаимодействия с растворителем.
Теплопроводность: электролиты обладают также свойством проводить тепло, что связано с их способностью переносить энергию в процессе проведения электрического тока.
Осмотическое давление: оно возникает вследствие разности концентраций раствора и растворителя. Электролиты способны создать осмотическое давление, вызывая движение растворителя через полупроницаемую мембрану.
Все эти физические свойства делают электролиты важными для множества процессов в живых организмах, в промышленности и в научных исследованиях.
Применение электролитов
Электролиты, благодаря своим уникальным свойствам проводимости, находят применение в различных областях науки и промышленности. Рассмотрим некоторые из них:
- Аккумуляторные батареи: Электролиты играют ключевую роль в работе аккумуляторов, обеспечивая передачу заряда между положительным и отрицательным электродами. Как правило, в аккумуляторах используются различные виды электролитов, включая кислотные, щелочные и солевые растворы.
- Электролитическая обработка металлов: Электролиты часто применяются для электрохимической обработки поверхности металлов. Например, электролитическое полирование позволяет достичь высокой степени глянца и гладкости поверхности, а электролитическое осаждение используется для нанесения покрытий с особыми свойствами (например, антикоррозийных).
- Электролитическая флотация: В области горного дела и обогащения полезных ископаемых электролиты используются для разделения полезных компонентов от отходов. Процесс электролитической флотации основан на различных свойствах минералов, позволяя получить концентраты с высоким содержанием полезных компонентов.
- Электролиз: Электролиты применяются в процессе электролиза, который используется для получения различных веществ с помощью электрического тока. Например, электролиз используется для производства алюминия, хлора, натрия и других важных химических веществ.
- Электролитические конденсаторы: Электролиты широко используются в электронике для создания электролитических конденсаторов. Эти конденсаторы служат для временного хранения и поставки электрической энергии и находят применение в широком спектре устройств, от электронных часов до компьютеров и мобильных телефонов.
Таким образом, электролиты играют важную роль в различных областях науки и промышленности, благодаря своей способности проводить электрический ток. Их применение не только позволяет создавать новые технологии, но и улучшать существующие процессы и устройства.
Взаимодействие электролитов с другими веществами
Один из примеров взаимодействия электролитов – образование двойных солей. Двойные соли образуются при взаимодействии двух или более солей. Например, при смешивании растворов сульфата натрия и хлорида калия может образоваться двойная соль – сульфат калия и натрия. Такие реакции часто сопровождаются обменом ионами между растворами и образованием новых растворов с другими ионами.
Кроме того, электролиты могут взаимодействовать с кислотами и основаниями, образуя соли. Например, раствор кислоты хлористоводородной и раствор основания гидроксида натрия могут взаимодействовать, образуя соль – хлорид натрия. Такие реакции называются нейтрализационными реакциями и часто сопровождаются выделением или поглощением энергии в виде тепла.
Также электролиты могут образовывать комплексные соединения при взаимодействии с комплексообразующими веществами. Комплексные соединения образуются при взаимодействии металлических ионов с органическими лигандами. Например, ион меди (II) может образовывать комплекс с аммиаком – он приобретает в этом случае голубую окраску.
Таким образом, взаимодействие электролитов с другими веществами является важным аспектом их химической активности. Эти взаимодействия позволяют получать новые соединения, проводить различные аналитические и синтетические процессы, а также изучать особенности реакции и влияние условий на ее протекание.




