Энергетический уровень в химии – это понятие, которое играет ключевую роль в объяснении различных химических процессов. Он представляет собой некую "ступеньку" или "этаж" на энергетической лестнице, которую атомы могут занимать. Каждый энергетический уровень соответствует определенному количеству энергии, и именно эта энергия определяет поведение атома в химических реакциях.
Суть энергетического уровня заключается в том, что электроны, находящиеся в атоме, могут находиться лишь на определенных энергетических уровнях. Каждый энергетический уровень имеет определенную энергию, которая связана с движением электрона от ядра к оболочке атома и обратно. При переходе электрона с одного уровня на другой происходит поглощение или выделение энергии, что приводит к возникновению различных физических и химических явлений.
Значение энергетического уровня в химии заключается в том, что оно позволяет объяснить и предсказать множество химических явлений и реакций. Зная энергетические уровни атомов, мы можем определить, какие химические связи будут образовываться или разрушаться, какие реакции будут протекать с выделением или поглощением энергии.
Энергетический уровень: определение и суть

Определение энергетических уровней в химии связано с квантовой механикой и понятием энергетического состояния системы. Каждый атом имеет определенное количество энергетических уровней, которые могут быть заполнены электронами. Энергетический уровень обладает определенной энергией, которая связана с положением электрона относительно ядра атома.
Суть энергетического уровня заключается в том, что электроны в атоме могут находиться только на определенных энергетических уровнях, а между ними - только определенные значения энергии. Электрон, находящийся на нижнем энергетическом уровне, имеет меньшую энергию, чем на более высоком уровне.
Наиболее низкий уровень энергии, на котором находятся электроны, называется основным энергетическим уровнем, а все остальные - возбужденными уровнями. Электроны могут переходить с одного энергетического уровня на другой, поглощая или испуская определенное количество энергии в виде квантов света. Энергетический уровень играет важную роль в объяснении атомных спектров и процессов химической связи.
Сущность энергетического уровня в химии
Энергетический уровень в химии относится к концепции электронных оболочек атома. Атомы состоят из электронов, которые движутся вокруг ядра по определенным наборам энергетических уровней. Каждый энергетический уровень имеет определенную энергию и может содержать определенное количество электронов.
Чем ближе энергетический уровень к ядру, тем ниже его энергия. Энергия электронов на более высоких энергетических уровнях больше, чем на нижних уровнях. Нижний энергетический уровень, ближайший к ядру, называется первым энергетическим уровнем, следующий – вторым, и так далее.
Поднятие или опускание электрона с одного энергетического уровня на другой сопровождается поглощением или высвобождением определенного количества энергии в виде фотонов. Это объясняет явление эмиссии или поглощения света атомами, которое является основой спектроскопии.
Понимание энергетических уровней помогает в анализе и понимании внутреннего строения атомов, их химических свойств и реакций. Это также важно для понимания энергетических переходов, которые происходят в процессе химических реакций и спектроскопии.
Значение энергетического уровня в химии

Энергетические уровни электрона в атоме обусловлены его квантовой природой и могут быть представлены в виде энергетической лестницы. Каждый уровень имеет определенное значение энергии, а электроны занимают эти уровни согласно принципу заполнения, который определяет порядок заполнения электронных орбиталей.
Значение энергетического уровня в химии состоит в том, что оно определяет способность атома или молекулы взаимодействовать с другими частями системы. Различные энергетические уровни электронов влияют на химические свойства вещества, такие как возможность образования связей, реакционная способность и термическая стабильность.
Понимание энергетических уровней позволяет ученым предсказывать и объяснять реакции и свойства вещества. Они играют важную роль при изучении вещества на молекулярном уровне и помогают разрабатывать новые материалы и химические соединения с определенными свойствами и функциями.
Таким образом, энергетический уровень в химии имеет фундаментальное значение, поскольку он определяет структуру и свойства вещества, а также служит основой для понимания и прогнозирования химических явлений и реакций.
Электронные переходы: связь с энергетическими уровнями
При электронных переходах электрон поглощает или испускает энергию в виде фотона. Если электрон переходит с более низкого энергетического уровня на более высокий, он поглощает энергию и фотон излучается. Если же электрон переходит с более высокого уровня на более низкий, электрон испускает энергию в виде фотона.
Электронные переходы происходят в атомах и молекулах при взаимодействии с электромагнитным излучением, например, с видимым или ультрафиолетовым светом. Они играют важную роль в различных физических и химических процессах, таких как оптическая спектроскопия, фотохимические реакции и фотоэлектрический эффект.
Энергетические уровни определяются квантовыми числами и характеризуются энергией электронов. Спектральные линии, наблюдаемые при электронных переходах, соответствуют разнице энергий между уровнями. Изучение электронных переходов и энергетических уровней позволяет углубить понимание строения атомов и молекул, а также их взаимодействия с окружающей средой.
Как электроны совершают переходы между энергетическими уровнями
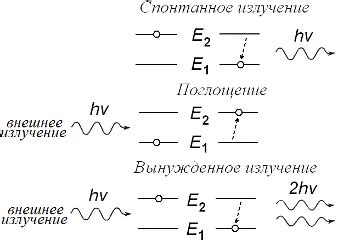
Электроны, находящиеся в атомах, могут занимать только определенные энергетические уровни или орбитали. Переход электронов между этими уровнями обусловлен поглощением или испусканием квантов электромагнитного излучения. В химии и физике эти переходы описываются понятием "квантового скачка".
Когда электрон получает энергию, например, от взаимодействия с фотоном света или другими частицами, он может перейти на более высокий энергетический уровень. Это называется возбуждением электрона. Возбужденный электрон остается на своем новом уровне в течение определенного времени.
Однако, возбужденный электрон, как правило, не может находиться на этом уровне вечно, поскольку он стремится к более низким энергетическим состояниям. Для того чтобы перейти на более низкий уровень, электрон должен избавиться от избыточной энергии. Он может сделать это, испуская фотон света или другого электромагнитного излучения с определенной длиной волны или энергией.
Переходы электронов между энергетическими уровнями сопровождаются поглощением или испусканием энергии в виде электромагнитного излучения. Таким образом, между уровнями возникают различные энергетические разрывы, которые соответствуют определенным диапазонам электромагнитного спектра, например, видимому свету или ультрафиолетовому излучению.
Изучение переходов электронов между энергетическими уровнями имеет важное значение для понимания и объяснения спектральных свойств атомов и молекул. Это позволяет ученым определить химический состав вещества, проводить исследования в области фотохимии и создавать новые технологии, такие как лазеры и светодиоды.
Квантовое число и энергетический уровень
Одним из основных квантовых чисел является главное квантовое число (n), которое определяет энергетический уровень атома или молекулы. Значение этого числа может быть любым положительным целым числом, начиная с 1. Чем больше значение главного квантового числа, тем выше энергетический уровень.
Кроме главного квантового числа, существуют еще три квантовых числа: азимутальное (l), магнитное (m) и спиновое (s). Азимутальное квантовое число определяет форму орбитали и может принимать значения от 0 до n-1. Магнитное квантовое число указывает на ориентацию орбитали в пространстве и изменяется в пределах от -l до +l включительно. Спиновое квантовое число характеризует спин электронов и может иметь значения +1/2 или -1/2.
Энергетический уровень атома или молекулы определяется сочетанием значений квантовых чисел. Квантовые числа также помогают объяснить свойства и поведение системы частиц на микроуровне. Квантовые числа и энергетические уровни являются основой для понимания строения и свойств атомов и молекул, а также для объяснения химических реакций и спектроскопических данных.
Как квантовое число определяет положение энергетического уровня
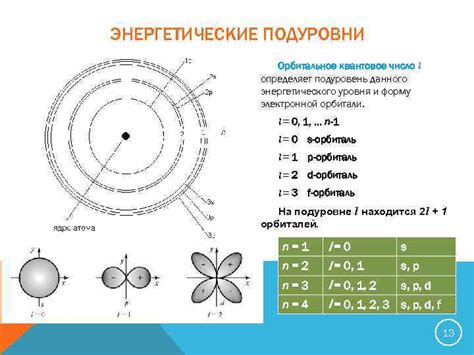
Квантовые числа представляют собой значения, которые определяют различные параметры электронов в атоме или молекуле. Одним из наиболее важных квантовых чисел является главное квантовое число (n), которое определяет основной энергетический уровень электрона.
Энергетические уровни атомов и молекул организованы по принципу возрастающей энергии. Чем выше значение главного квантового числа (n), тем больше энергия электрона и тем дальше он располагается от ядра.
Другим важным квантовым числом является азимутальное квантовое число (l), которое определяет форму орбитали электрона. Значение азимутального квантового числа указывает на тип орбитали: l = 0 соответствует s-орбитали, l = 1 - p-орбитали, l = 2 - d-орбитали и так далее.
Магнитное квантовое число (m) определяет ориентацию орбитали в трехмерном пространстве. Значение магнитного квантового числа может быть от -l до +l.
Таким образом, комбинация различных квантовых чисел позволяет точно определить положение энергетического уровня электрона в атоме или молекуле.




