Распад электролита на ионы - это процесс, в результате которого электролитический раствор разделяется на положительно заряженные ионы катионов и отрицательно заряженные ионы анионов. Этот процесс происходит благодаря диссоциации или ионизации электролита под влиянием физических или химических факторов.
Механизм распада электролита на ионы может быть вызван различными факторами. Один из наиболее распространенных факторов - это растворение электролита в воде. Вода, являясь полярным растворителем, способна разрывать связи между ионами, образуя гидратированный оболочки вокруг ионов. Это приводит к высвобождению свободных ионов и, следовательно, к распаду электролита на ионы.
На распад электролита на ионы также могут влиять химические факторы, такие как изменение pH среды. Когда pH среды изменяется, он может влиять на степень ионизации электролита. Например, в кислой среде ионы водорода H+ соревнуются с ионами металла в электролите, вызывая их распад на ионы.
Важно отметить, что электролиты различаются по своей способности к ионизации. Некоторые электролиты диссоциируют полностью, а другие только частично. Это связано с их устойчивостью в растворе и взаимодействием с водой. Эти факторы в совокупности вызывают распад электролита на ионы и обуславливают его поведение в растворе.
Электролиты и ионы: что происходит при распаде

Распад электролита на ионы происходит из-за диссоциации или ионизации. Диссоциация происходит в случае, когда молекулы электролита разделяются на положительные и отрицательные ионы без образования новых связей. Например, вода (H2O) может диссоциировать на положительные ионы водорода (H+) и отрицательные ионы гидроксида (OH-).
Ионизация происходит, когда электролит реакции с веществом в растворе или расплаве и образует новые связи. Например, соляная кислота (HCl) ионизируется в растворе воды, образуя положительные ионы водорода (H+) и отрицательные ионы хлорида (Cl-).
При распаде электролита на ионы, образовавшиеся ионы могут перемещаться свободно в растворе или расплаве и проводить электрический ток. Под влиянием электрического поля, положительные ионы движутся к отрицательному электроду (аноду), а отрицательные ионы - к положительному электроду (катоду). Это явление называется ионной проводимостью.
Распад электролитов на ионы имеет важное значение в химической промышленности, медицине и других областях. Например, процесс электролиза основан на распаде электролита на ионы в растворе или расплаве, что позволяет получить различные продукты.
| Тип электролита | Ионы |
|---|---|
| Кислота | Протоны (H+) |
| Основание | Гидроксидные ионы (OH-) |
| Соль | Положительные ионы металла и отрицательные ионы неметалла |
Источники:
- https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_General_Chemistry_(Petrucci_et_al.)/02%3A_Atoms,_Molecules,_and_Ions/2.10%3A_Ionic_Comounds
- https://byjus.com/chemistry/ionization-vs-dissociation-difference/
Что такое электролит и какие его свойства
- Ионизация: Когда электролит растворяется в воде или плавится, его молекулы разделяются на ионы с положительным и отрицательным зарядом.
- Проводимость: Ионы, образованные электролитом, могут двигаться в растворе и проводить электрический ток.
- Разделяемость: Электролиты могут быть разделены на положительные и отрицательные ионы при использовании специальных методов, таких как электрофорез или электролиз.
- Концентрация ионов: Электролиты могут иметь различную концентрацию ионов, что влияет на их электрические свойства и реактивность.
- Способность реагировать: Ионы, образованные электролитом, могут участвовать в химических реакциях, образуя новые соединения.
Электролиты играют важную роль в жизни организмов, так как они влияют на работу клеток и тканей. Они также широко используются в промышленности и научных исследованиях для проведения электролитических процессов, электрохимических реакций и других приложений.
Механизм распада электролита на ионы
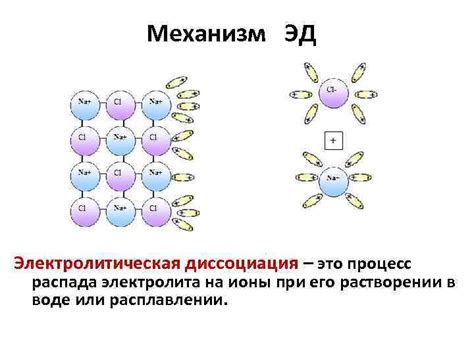
Когда электролит попадает в раствор, молекулы его разбиваются на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами, а отрицательно заряженные – анионами.
Существуют различные механизмы распада электролита на ионы в зависимости от его типа. Например, водородные ионы (H+) могут образовываться при диссоциации кислот, а гидроксидные ионы (OH-) могут образовываться при диссоциации щелочей.
При повышенных температурах электролиты могут распадаться на ионы в результате термического распада. Данный процесс может быть обратимым или необратимым в зависимости от условий и реакционной среды.
Распад электролита на ионы является важным химическим процессом, который играет роль во многих аспектах нашей повседневной жизни, начиная от химических реакций в организмах и окружающей среде, заканчивая производством и использованием различных химических соединений.
Роли положительных и отрицательных ионов в процессе
При распаде электролита на ионы, положительные и отрицательные ионы играют различные роли в процессе.
Положительные ионы, такие как катионы, образуются при потере одного или нескольких электронов атомами. Они обладают положительным зарядом и перемещаются к отрицательно заряженной анодной области. Катионы играют важную роль в электролитических процессах, таких как электролиз и гальваническая коррозия. Они могут быть задействованы в электрохимических реакциях на электродах и служат для транспорта ионов через электролит.
Отрицательные ионы, такие как анионы, образуются при приобретении одного или нескольких электронов атомами. Они обладают отрицательным зарядом и перемещаются к положительно заряженной катодной области. Анионы также играют важную роль в электролитических процессах, особенно в электролизе и электрохимических реакциях. Они могут участвовать в процессах окисления и восстановления, обмена ионами и переноса электрона.
| Роль | Положительные ионы | Отрицательные ионы |
|---|---|---|
| Перемещение | Двигаются к аноду | Двигаются к катоду |
| Участие в электролизе и электрохимических реакциях | Служат для транспорта ионов и участвуют в реакциях на электродах | Участвуют в окислительно-восстановительных реакциях и обмене ионами |
Важно отметить, что регуляция концентрации положительных и отрицательных ионов в электролите имеет большое значение для успешного протекания электролитических процессов. Превышение или недостаток определенных ионов может вызвать нежелательные эффекты, такие как коррозия электродов или неправильное функционирование электролитической ячейки.
Факторы, влияющие на скорость распада электролита на ионы

Скорость распада электролита на ионы может зависеть от нескольких факторов:
1. Концентрация электролита: Чем выше концентрация электролита, тем более интенсивно происходит его распад на ионы. Это связано с увеличением количества частиц, способных проводить электрический ток.
2. Температура: Повышение температуры обычно увеличивает скорость распада электролита на ионы. Возрастание температуры обусловлено увеличением кинетической энергии частиц, что способствует более активным столкновениям и заметному увеличению скорости реакции.
3. Размер частиц: Более мелкие частицы электролита имеют большую поверхность контакта с растворителем, что способствует более интенсивному распаду на ионы. Это связано с увеличением количества частиц, вступающих в контакт с растворителем.
4. Поларность растворителя: Если растворитель имеет высокую полярность, то он будет быстро разделять ионы электролита, что ускорит его распад. Полярные растворители обладают способностью эффективно отделять положительно и отрицательно заряженные частицы электролита.
5. Присутствие катализаторов: Некоторые вещества, называемые катализаторами, могут значительно ускорить распад электролита на ионы. Катализаторы предоставляют дополнительные пути реакции, снижая энергию активации и увеличивая скорость химической реакции.
Указанные факторы могут существенно влиять на скорость распада электролита на ионы и могут быть использованы для управления и контроля данного процесса.




