pH - это мера кислотности или щелочности раствора. Однако, несмотря на свою простоту, это понятие весьма сложное и интересное. pH шкала имеет диапазон от 0 до 14, где значение pH 7 является нейтральным. Значения меньше 7 указывают на кислотность, а значения больше 7 - на щелочность.
Чтобы лучше понять, почему pH может колебаться от 0 до 14, нужно вспомнить о реакции между кислотами и щелочами. Кислоты отдают водородные ионы (H+), а щелочи принимают ионы водорода.
Когда pH меньше 7, это означает, что концентрация водородных ионов в растворе выше, и, следовательно, раствор является кислотным. При pH равном или большем 7, концентрация водородных ионов становится ниже, и раствор становится щелочным.
Поэтому, pH колеблется от 0 до 14, чтобы охватить различные уровни кислотности и щелочности. Нейтральный pH равен 7, что означает равномерное распределение водородных ионов и гидроксильных ионов. Но в реальности большинство растворов имеют pH вне рамок нейтрального значения. Это обусловлено химическими реакциями и взаимодействием различных веществ в растворе.
Что такое pH и почему его значения колеблются в пределах от 0 до 14?

Значение pH ниже 7 указывает на кислотную среду, где концентрация ионов водорода выше, чем концентрация гидроксидных ионов (OH-). Чем ниже значение pH, тем больше кислотные свойства раствора.
Значение pH выше 7 указывает на щелочную (основную) среду, где концентрация гидроксидных ионов выше, чем концентрация ионов водорода. Чем выше значение pH, тем более щелочные свойства имеет раствор.
Значение pH 7 считается нейтральным, где концентрация ионов водорода и гидроксидных ионов равны.
Это соглашение о диапазоне pH от 0 до 14 базируется на логарифмической шкале. Каждое целочисленное изменение величины pH на шкале означает изменение концентрации ионов водорода в 10 раз. Например, раствор с pH 3 является 10 раз более кислотным, чем раствор с pH 4.
Этот диапазон pH от 0 до 14 позволяет охватить различные типы растворов, от очень кислотных до очень щелочных.
Что такое pH и как его измеряют?
pH-шкала имеет диапазон от 0 до 14. Значение pH 7 считается нейтральным, что означает, что концентрация ионов водорода в растворе равна концентрации гидроксидных ионов (OH-). Значение pH меньше 7 указывает на кислотность раствора, а значение pH больше 7 указывает на щелочность раствора.
Определение pH осуществляется при помощи специальных приборов - pH-метров или специальных тест-полосок. pH-метр представляет собой электронный прибор, который измеряет разность потенциалов между электродами, погруженными в раствор. Тест-полоски содержат химические индикаторы, которые меняют свой цвет в зависимости от pH-значения раствора. По этому изменению цвета можно определить значение pH.
Влияние концентрации ионов водорода
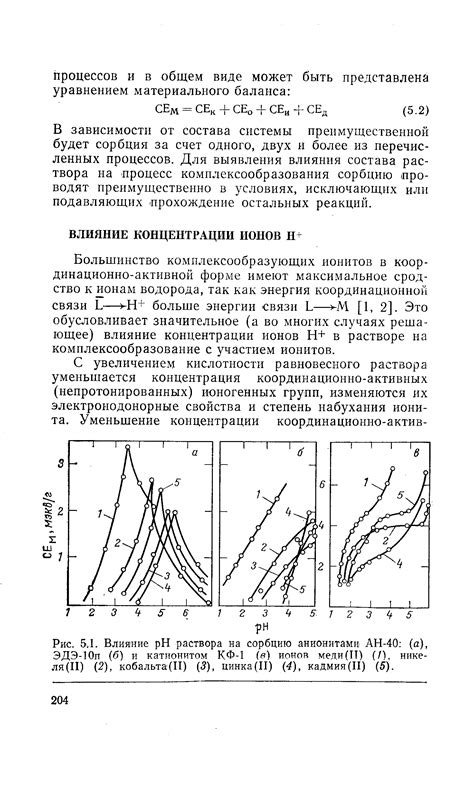
Концентрация ионов водорода в растворе может быть описана с помощью формулы pH = -log[H+], где [H+] представляет собой концентрацию ионов водорода в молях на литр. Эта формула позволяет установить связь между концентрацией ионов водорода и значением pH.
Влияние концентрации ионов водорода проявляется в различных аспектах. Например, изменение pH может влиять на химические реакции, так как многие из них зависят от активности водородных ионов. Также значение pH может влиять на растворимость солей, реакции гидролиза и скорость химических реакций.
Понимание влияния концентрации ионов водорода на pH является важным для многих научных и практических областей, включая химию, биологию и медицину. Изучение pH позволяет определить кислотность или щелочность раствора, что имеет значение при разработке и использовании различных продуктов и процессов.
Сочетание кислот и оснований
Когда кислоты и основания встречаются в растворе, они могут взаимодействовать, образуя новые соединения. Такие реакции называются реакциями нейтрализации.
Когда кислота и основание соединяются, они образуют соль и воду. Это называется нейтрализацией, так как реакция приводит к установлению равновесия и изменению pH раствора.
Для примера, реакция между сильной кислотой, такой как соляная кислота (HCl), и сильным основанием, таким как гидроксид натрия (NaOH), может быть представлена следующим уравнением реакции:
| Реагенты | Продукты |
|---|---|
| HCl | NaCl + H2O |
В результате этой реакции образуется соль натрия (NaCl) и вода (H2O).
Часто, реакции нейтрализации практически полностью изменяют pH раствора, близкий к 7, что считается нейтральным pH. Если есть избыток одного из реагентов, то pH раствора после реакции может быть немного кислым или щелочным.
Образование солей и воды в результате реакции между кислотами и основаниями является основной причиной колебания pH в диапазоне от 0 до 14.
Что значат значения pH от 0 до 14?

Значение pH основано на концентрации ионов водорода (H+) в растворе. Более высокая концентрация ионов H+ приводит к более низкому значению pH, что указывает на кислотность раствора. В то же время, более низкая концентрация ионов H+ приводит к более высокому значению pH, что указывает на щелочность раствора.
Значение pH 7 соответствует нейтральному раствору, в котором концентрация ионов H+ и OH- одинакова. Растворы с значениями pH меньше 7 считаются кислотными, а растворы с pH больше 7 – щелочными.
| pH | Тип раствора |
|---|---|
| 0 | Сильная кислота |
| 1-6 | Кислота |
| 7 | Нейтральный |
| 8-14 | Щелочь |
| 14 | Сильная щелочь |
Различные вещества имеют различные значения pH, и значение pH может оказывать влияние на множество процессов и реакций в природе и в промышленности. Например, большинство живых организмов поддерживают определенное pH окружающей среды, и любые изменения pH могут повлиять на их жизнедеятельность.
Измерение pH является важным инструментом для химиков, биологов, аналитических лабораторий и других профессионалов, и помогает в понимании свойств и реактивности различных веществ.
Какие вещества являются кислотными?
Кислоты могут быть органическими или неорганическими, в зависимости от химической природы их молекул. Неорганические кислоты обычно представлены элементами или соединениями, содержащими водород. Некоторые из наиболее распространенных неорганических кислот включают соляную кислоту (HCl), серную кислоту (H2SO4), азотную кислоту (HNO3) и фосфорную кислоту (H3PO4).
Органические кислоты являются соединениями, содержащими карбонильную группу -C=O и группу гидроксила -OH. Органические кислоты, такие как уксусная кислота (CH3COOH), масляная кислота (C17H35COOH) и лимонная кислота (C6H8O7), являются важными компонентами в пище, лекарствах и других областях.
Кроме того, некоторые вещества могут проявлять кислотные свойства в определенных условиях, например, вода может проявлять слабокислотные свойства в растворе, содержащем кислород. Это связано с его способностью диссоциировать и образовывать оксид водорода (H2O → H+ + OH-).
Знание о кислотности различных веществ имеет большое значение в химии и науке в целом, так как это помогает понять и объяснить множество физических и химических процессов, происходящих в природе и в лабораторных условиях.
Какие вещества являются щелочными?
Щелочи находят широкое применение в различных сферах, включая химическую, фармацевтическую и бытовую. Они используются для регулирования pH значения в различных продуктах, процессах и системах. Вещества, которые часто являются щелочными, включают:
- Гидроксиды: натриевый гидроксид (пищевая сода), калиевый гидроксид (каустическая сода), аммиак.
- Соли: карбонаты (натриевый карбонат), гидрокарбонаты (натриевый гидрокарбонат), ацетаты (натриевый ацетат).
- Органические щелочи: амин (триметиламина), триэтаноламин.
Это лишь некоторые примеры щелочных веществ. В зависимости от специфических свойств и состава, щелочи могут иметь различные применения, включая использование в качестве моющих средств, отвердителей для воды, антацидов и многое другое.
Как изменение pH влияет на химические реакции?
При изменении pH происходит изменение электрохимического баланса в растворе. Большинство химических реакций требуют определенного уровня pH для эффективной работы. Например, ферменты, которые играют важную роль во многих биохимических процессах, могут быть очень чувствительны к изменению pH. Если pH слишком высокий или низкий, ферменты могут денатурироваться и потерять свою активность.
Также изменение pH может изменить ионизацию молекул и реакционную активность различных веществ. Например, многие кислоты и основания могут изменять свою реакционную способность в зависимости от pH раствора. Ионизация молекул также может повлиять на скорость реакций и образование промежуточных продуктов.
Следовательно, изменение pH может оказывать существенное влияние на химические реакции, включая скорость реакций, степень ионизации молекул и активность биохимических процессов. Поэтому контроль pH является важным аспектом во многих химических и биологических системах.
Важность понимания pH для биологических систем
Влияние pH на ферментативные реакции: Ферменты, такие как энзимы, отвечают за существенную часть химических реакций, происходящих в биологических системах. Они обладают определенной оптимальной кислотностью, при которой активность их максимальна. Большинство ферментов работают эффективно в узком диапазоне pH. Понимание и контроль pH позволяют поддерживать необходимые условия и обеспечивать нормальное функционирование ферментативных реакций.
Взаимодействие pH с биологическими молекулами: Взаимодействие pH с молекулами белка и ДНК может влиять на их структуру и функциональность. Белки обладают определенным трехмерным складыванием, которое зависит от pH окружающей среды. Изменение pH может приводить к изменению заряда и структуры белка, что влияет на его активность и взаимодействие с другими молекулами в клетке. Также, изменения pH могут влиять на стабильность ДНК и способность молекулы ДНК связываться с другими биологическими компонентами.
Регуляция внутренней среды: pH играет важную роль в поддержании гомеостаза и регуляции внутренней среды организмов. Буферные системы в организме помогают предотвратить значительные изменения pH и поддерживать его на стабильном уровне необходимом для нормального функционирования клеток. Например, кровь человека должна быть слабощелочной для поддержания оптимальных условий для метаболических процессов и деятельности ферментов.
Понимание pH и его влияния на биологические системы имеет важное значение для наших знаний о живых организмах и позволяет нам более глубоко исследовать процессы, происходящие внутри них.
Как поддерживать оптимальный pH в организме?
Существует несколько способов поддерживать оптимальный pH в организме:
1. Правильное питание. Употребление здоровой пищи играет решающую роль в поддержании оптимального pH. Овощи, фрукты, орехи и зеленые листья содержат алкализирующие вещества, которые помогают уравновесить уровень кислотности в организме. Одновременно следует ограничить потребление кислотообразующих продуктов, таких как мясо, молочные продукты, спиртные напитки и сладости.
2. Питье достаточного количества воды. Регулярное питье важно для поддержания оптимального pH в организме. Вода помогает избавиться от кислотных отходов и уравновесить уровень кислотности.
3. Спортивная активность. Физическая активность способствует повышению уровня кислорода в организме, что сокращает количество кислотных отходов. Регулярные упражнения и физическая активность помогают поддерживать оптимальный pH.
4. Избегание стресса. Стрессовые ситуации могут привести к увеличению уровня кислотности в организме. Постоянное напряжение и стресс могут нарушить оптимальное pH. Регулярное занятие релаксационными техниками и управление стрессом помогут поддерживать оптимальный pH.
Соблюдение этих простых рекомендаций поможет поддерживать оптимальный pH в организме и способствовать его нормальному функционированию.




