Соль - это не только популярный приправа в кулинарии. Этот простой и распространенный минерал, также известный как хлорид натрия, имеет много разнообразных свойств и применений. Но что же представляет собой соль с физической точки зрения?
Соль в своей чистой форме представляет собой белые кристаллы, которые часто имеют кубическую или октаэдрическую форму. Эти кристаллы обладают хрупкой структурой и легко растворяются в воде, образуя прозрачный раствор. Важно отметить, что соль обладает свойством поглощать влагу из окружающей среды, поэтому она часто кладется в специальные контейнеры или добавляется в продукты, чтобы предотвратить их разлагание.
Физические свойства
Одно из главных физических свойств соли - ее растворимость. Когда соль растворяется в воде, она образует ионные соединения. Катионы натрия (+) и анионы хлора (-) разделяются в растворе, приводя к образованию электрического заряда и способствуя проводимости раствора. Именно поэтому вода с солью проводит электрический ток и используется в таких процессах, как электролиз и очистка воды.
Кроме того, соль обладает свойством плавления и кристаллизации при определенной температуре. При нагревании соль плавится и формирует полупрозрачную жидкость. После охлаждения эта жидкость кристаллизуется и превращается в твердые кристаллы соли. Этот процесс может быть использован для получения соли в единичных кристаллах или для очистки природной соли от примесей.
Таким образом, соль - это не только способ придать блюдам вкус, но и интересное исследовательское поле с физической точки зрения. Этот минерал обладает множеством уникальных свойств и способен проявлять различные поведенческие аспекты в разных условиях. Что еще скрывает в себе эта простая, но такая важная субстанция? Взгляните на этот материал и узнайте больше о его физических свойствах и применении в различных областях жизни.
Вещественное соединение между ионами

Ионы – это атомы или группы атомов, обладающие электрическим зарядом. В соли положительный ион называется катионом, а отрицательный – анионом. Эти ионы притягиваются друг к другу благодаря силе электростатического притяжения.
Соль обычно образуется при реакции нейтрализации, когда кислота реагирует с основанием. В результате реакции образуются ионы, которые связываются в кристаллическую структуру, образуя соль.
Кристаллическая структура соли обеспечивает ее высокую устойчивость и твердотельные свойства. Кристаллы соли образуют регулярную решетку, в которой каждый ион окружен ионами другого заряда. Это обуславливает характерные свойства соли, такие как хрупкость, высокая температура плавления и растворимость в воде.
Уникальные свойства солей
Соли обладают рядом уникальных свойств, которые делают их особенно интересными и полезными:
1. Растворимость: Соли могут быть растворимыми или нерастворимыми в воде. Растворимость зависит от состава и структуры солей, а также от условий окружающей среды.
2. Кристаллическая структура: Соли образуют кристаллическую структуру, которая может иметь различные формы и регулярные геометрические фигуры.
3. Цветность: Многие соли обладают характерным цветом, который может быть использован для их идентификации.
4. Вкус: Некоторые соли обладают характерным вкусом, который может быть соленым, кислым или горьким.
5. Электролитическое поведение: Соли, разделяясь на ионы в растворе, обладают способностью проводить электрический ток.
6. Катионообменная способность: Соли могут проявлять катионообменную способность, обменивая один ион на другой.
7. Коррозионная активность: Некоторые соли могут обладать коррозионной активностью и способностью разрушать металлы и другие материалы.
8. Анионообменная способность: Соли могут проявлять анионообменную способность, обменивая один ион на другой.
Все эти свойства делают соли важными компонентами в химии, науке, пищевой промышленности и жизни в целом.
Кристаллическая структура кристаллов солей
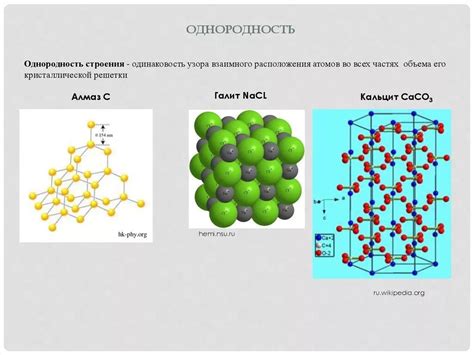
Кристаллические структуры солей обладают особенностями, обусловленными их составом и свойствами компонентов. Соли образуют геометрически регулярные кристаллические структуры, которые состоят из упорядоченного расположения ионов. Так как ионы вещества обладают электрическим зарядом, они взаимодействуют друг с другом на молекулярном уровне и образуют связи. В результате образуется регулярная решетка, характеризующаяся своими особенностями.
Кристаллическая решетка солей может иметь различное количество измерений - от одномерных до трехмерных. В одномерных решетках ионы располагаются только по одной линии, в двумерных - по двум перпендикулярным друг другу плоскостям, а в трехмерных - по трем перпендикулярным друг другу осям.
Каждая решетка состоит из элементарной ячейки, которая является наименьшей единицей кристаллической структуры соли. Элементарная ячейка содержит ионы, между которыми имеются определенные связи. Она повторяется по всем направлениям и образует сетку кристаллической решетки.
Структура кристаллов солей может быть описана с помощью различных моделей. Наиболее распространенные модели - ионно-решеточная модель и сфероида
Соли как кондукторы тока
Соли, будучи веществами, обладают физическими свойствами, позволяющими им быть отличными кондукторами тока. В основе этого лежит способность солей образовывать ионные решения, состоящие из положительно и отрицательно заряженных частиц.
Когда соль растворяется в воде или другом растворителе, ее молекулы разделяются на ионы, позитивно и негативно заряженные. Вода, также имеющая полярные свойства, облепляет эти ионы, разделяя их и создавая электрическую проводимость.
Электрический ток проходит через сольные растворы благодаря движению заряженных ионов. Позитивно заряженные ионы движутся к отрицательно заряженному электроду, а отрицательно заряженные ионы – к положительно заряженному электроду. Таким образом, соли обеспечивают проводимость электрического тока в растворах.
Важно отметить, что способность солей кондуцировать ток зависит от их растворимости. Нерастворимые соли (например, осадки) не образуют ионные растворы и не могут служить кондуктором тока.
Пользуясь этим свойством солей, их широко используют в различных областях, таких как электрохимия, биология и индустрия. Многие электрохимические процессы, включая электролиз и аккумулирование электрической энергии, основаны на кондуктивности сольных растворов.
Влияние солей на физические свойства вещества

Соли имеют значительное влияние на физические свойства вещества. Одно из основных свойств солей - растворимость. Многие соли легко растворяются в воде, образуя ионы в растворе. Это свойство делает соли полезными в процессах экстракции, очистки и консервирования продуктов.
Соли также влияют на плотность и вязкость вещества. Некоторые соли могут увеличивать плотность растворов, что используется, например, в производстве стекла. Вязкость также может изменяться под влиянием солей, что применяется в некоторых технологических процессах, например, в пищевой и химической промышленности.
Соли могут влиять и на температуру плавления и кипения вещества. Добавление солей в вещество может снижать температуру плавления или повышать температуру кипения. Это свойство используется, например, в промышленности для изменения физических свойств материалов в процессе производства.
Еще одним важным физическим свойством, которое изменяется под влиянием солей, является электропроводность. Многие соли обладают способностью проводить электрический ток в разных степенях. Это свойство используется в батареях, аккумуляторах, электролизе и других процессах и устройствах, связанных с протеканием электрического тока.
Таким образом, можно констатировать, что соли имеют значительное влияние на физические свойства вещества. Они изменяют растворимость, плотность и вязкость, температуру плавления и кипения, а также электропроводность. Эти свойства делают соли важными и полезными в различных областях науки и технологии.
Соли в химических реакциях
В химических реакциях, соли могут проявлять свои активные свойства. Они могут расщепляться на ионы при взаимодействии с другими веществами, что делает их важными в качестве электролитов. Соли также могут выступать в качестве катализаторов, ускоряя химические реакции. Они могут быть использованы для изменения скорости реакции или переключения реакционного механизма.
Соли могут также претерпевать различные химические реакции, такие как обмен ионами, осаждение или растворение. Эти реакции могут привести к образованию новых солей или изменению их структуры и свойств. Соли также могут взаимодействовать с другими веществами, образуя комплексы или координационные соединения. Эти реакции могут изменить цвет или растворимость солей, что активно используется в химическом анализе и качестве индикаторов.




